致敏反应试验之豚鼠最大剂量试验
- 2019-11-12 18:06
- 作者:
- 来源:中国医药报
试验原理
豚鼠最大剂量试验(GPMT)通过皮内注射诱导、斑贴激发的方式将试验样品或其浸提液作用于豚鼠,在规定时间内观察豚鼠激发部位皮肤反应,以评价试验样品在试验条件下使豚鼠产生皮肤致敏反应的潜能。本试验是按照国家标准GB/T16886.10-2017《医疗器械生物学评价第10部分:刺激与皮肤致敏试验》的规定进行的。
仪器设备试剂
仪器设备超净工作台、恒温水浴箱、压力蒸汽灭菌器等。
试剂符合药典要求的极性和非极性浸提介质、弗氏完全佐剂、十二烷基硫酸钠等。
试验前准备
样品制备
试验样品信息委托单位应按要求提交试验样品的详细资料。
试验样品制备根据GB/T16886.12-2017《医疗器械生物学评价第12部分:样品制备与参照材料》的原则制备试验样品。要考虑试验样品在人体应用时的接触性质,如可直接用于试验,则应不加改变直接用于试验;否则,可制备浸提液用于试验。宜同时采用极性和非极性两种浸提介质,且在无菌条件下制备浸提液。
阴性对照制备阴性对照需同时进行,采用试验样品制备所用的同批号浸提介质,不加试验样品并在同条件下制备。
试验动物
GB/T16886.10-2017《医疗器械生物学评价第10部分:刺激与皮肤致敏试验》指定白化豚鼠作为皮肤致敏试验动物。Hartley白化豚鼠作为皮肤致敏试验动物历史已久,有丰富的试验资料积累。所以,选用Hartley白化豚鼠作为皮肤致敏试验动物是合理的。关于试验动物的描述,举例如下。
名称:Hartley白化豚鼠;来源:具有试验动物生产许可证号的供应商;性别:雌(未孕)、雄不限;体重范围:300g~400g;年龄:初成年;适应时期:至少5天;动物数目:试验动物10只,对照动物5只;标记方法:苦味酸涂染法。关于试验动物的管理举例,见表1。
试验材料如为粉剂或液体,应至少使用10只动物接触试验样品,至少使用5只动物作为对照组。如需进行预试验应另取动物。
对于浸提液试验,应至少使用10只动物接触每一种浸提液,至少使用5只动物作为每一溶剂对照组。如需进行预试验应另取动物。
10只试验动物和5只对照动物如全部呈阴性反应,则再进行10只试验动物加5只对照动物试验也未必会出现阳性结果。但是,如出现任何疑似反应,应进行再激发(见本试验的“分析判定”部分所述),如仍有疑似反应,则要重新进行试验,最少采用20只试验动物和10只对照动物。
试验过程
预试验
其目的在于确定主试验中所用试验样品的浓度。对于主试验的局部诱导阶段,宜选择可导致轻度至中度红斑、但不对动物产生其他不良作用的最高浓度作为试验样品浓度;对于主试验的激发阶段,宜选择不出现红斑的最高浓度作为试验样品浓度。通用溶剂制备的未稀释的浸提液不需要进行预试验。
将试验样品的系列稀释物局部应用于动物腹侧部位,至少采用3只动物。24小时后除去封闭性包扎带和敷贴片,按Magnusson和Kligman分级标准评价贴敷部位的红斑与水肿反应程度见表2。
主试验
在试验开始之前,对每只动物称重并编号后,用电剃刀剃去豚鼠全部试验部位(常为背部)的毛发,并观察每只动物的总体健康状况。
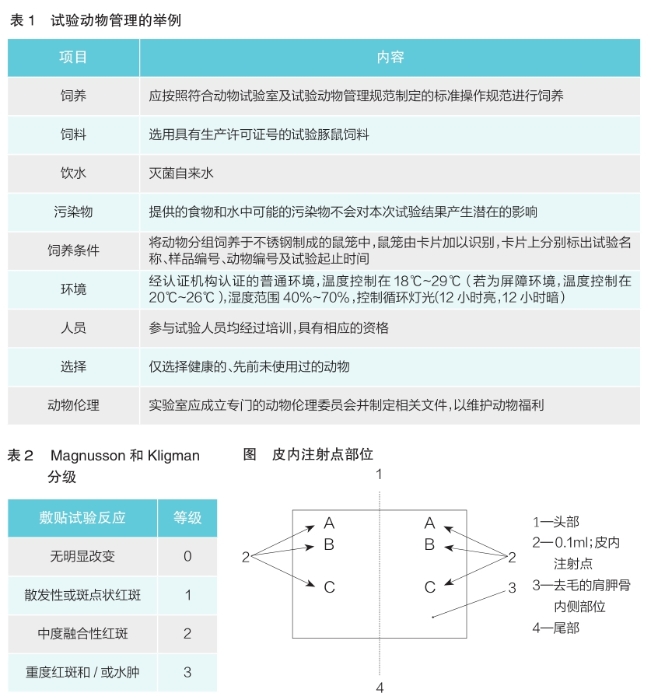
皮内诱导阶段在每只动物去毛的肩胛骨内侧部位成对皮内注射0.1ml,注射点部位见图所示。
部位A:注射弗氏完全佐剂与浸提介质50∶50(体积比)比例混合的稳定性乳化剂。对于水溶性材料,溶剂选用生理盐水(符合英国药典、美国药典或中国药典要求)。
部位B:注射试验样品(未经稀释的浸提液);对照组动物仅注射相应溶剂。
部位C:将试验样品(部位B中采用的浓度)以50∶50的体积比例与弗氏完全佐剂和溶剂(50%)配制成的乳化剂混合后进行皮内注射;对照组注射阴性对照液与佐剂配制成的乳化剂。
局部诱导阶段皮内诱导阶段后(7±1)天,按皮内诱导阶段部位B中选定的浓度,采用面积约8cm<sup>2</sup>的敷贴片(滤纸或吸水性纱布块)局部贴敷于每只动物的肩胛骨内侧部位,覆盖诱导注射点。在局部敷贴应用前(24±2)小时,如皮内诱导阶段部位B中选定的浓度未产生刺激反应,试验区用10%十二烷基硫酸钠进行预处理,按摩导入皮肤。用封闭式包扎带固定敷贴片,并于(48±2)小时后除去包扎带和敷贴片。对照组动物使用阴性对照同法操作。
激发阶段局部诱导阶段后(14±1)天,用试验样品激发全部试验动物和对照动物。按皮内诱导阶段部位C中选定的浓度,将适宜的敷贴片或载样器皿置于试验样品或阴性对照介质中浸透,局部贴敷于诱导阶段未试验部位,如每只动物的上腹部。用封闭式包扎带固定,并于(24±2)小时后除去包扎带和敷贴片。
分析判定
结果观察
除去敷贴片后(24±2)小时和(48±2)小时观察试验组和对照组动物激发部位皮肤情况及皮肤反应,推荐在自然光或全光谱光线下观察皮肤反应。按表2给出的Magnusson和Kligman分级标准对每一激发部位和每一观察时间皮肤红斑和水肿反应进行描述并分级。记录试验方法、动物体重、试验过程中所观察到的任何现象及结果。
结果评价
按Magnusson和Kligman分级标准,对照组动物分级小于1,而试验组中分级大于或等于1时,一般提示致敏。若对照组动物分级大于或等于1时,试验动物反应超过对照动物中最严重的反应,则认为致敏。如为疑似反应,推荐进行再激发以确认首次激发结果。试验结果显示为试验和对照动物中的阳性激发结果的发生率。
偶尔,试验组出现反应的动物数量多于对照组,但反应强度并不超过对照组,在此情况下,可能需要在首次激发后1~2周进行再次激发,以明确反应。所用方法与首次激发相同,采用动物未试验的一侧部位。
注意事项
1.该试验适用于评价与人体接触所有类型的产品及其浸提液,特别适用于对单一化学物质致敏潜能的评价。该试验为首选豚鼠致敏试验。
2.用封闭式包扎带固定动物时,宜注意使动物能正常呼吸。首选弹性包扎带,宜由经过培训的专业人员进行操作。
3.为了对主试验期间可能发生的干扰读数的皮肤过度反应状况进行评价,宜考虑对全部动物进行弗氏完全佐剂注射的预处置。
4.在结果观察阶段,为了将结果评价偏差降至最低,特别推荐在不知试验处置信息的情况下进行读数。
5.对于豚鼠致敏试验,为了确保试验的再现性和敏感性,每6个月一般要采用10只动物用于阳性对照。在以比每6个月更频繁的频率进行阳性对照物质试验时,可采用较少的豚鼠,宜至少采用5只试验动物用于阳性物质,以及5只对照动物。
起草人:孙晓霞(山东省医疗器械产品质量检验中心)复核人:陈亮杜晓丹(中国食品药品检定研究院)(本文摘编自《医疗器械安全通用要求检验操作规范》,中国食品药品检定研究院组织编写,中国医药科技出版社出版。)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:何璇)
分享至
右键点击另存二维码!
-
相关阅读
- 皮肤变态反应试验技术指导原则征求意见
-
为你推荐