浅谈美国505(b)(2)申报途径及中国企业的拓展之路
- 2020-02-19 10:38
- 作者:丁恩峰
- 来源:中国食品药品网
美国FDA是全球药品监管机构的风向标,历来以高标准和严要求而著称,其新药审评审批尺度和技术标准,一直引领着全球药品研发的潮流与方向。对于新药审批,FDA有着严格的法规制度和管控体系:1938年颁布的《联邦食品、药品和化妆品法案》(FD&C Act)规定,所有新药在美国上市之前都必须向FDA提出正式的新药申请。1984年美国国会通过了《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment),修订后的《联邦食品、药品和化妆品法案》505部分为新药申请提供了三条路径:
505(b)(1):申请包含完整安全性和有效性研究报告。
505(b)(2):申请包含完整安全性和有效性研究报告,但至少有部分信息来源于非申请者开展或申请者无权引用的研究。
505(j) :申请包含信息证明拟申报药物与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应证等。
505(b)(1)和505(b)(2)都属于新药申请(NDA, new drug application),而505(j)则属于简略新药申请(ANDA, abbreviated new drug application),即仿制药申请。
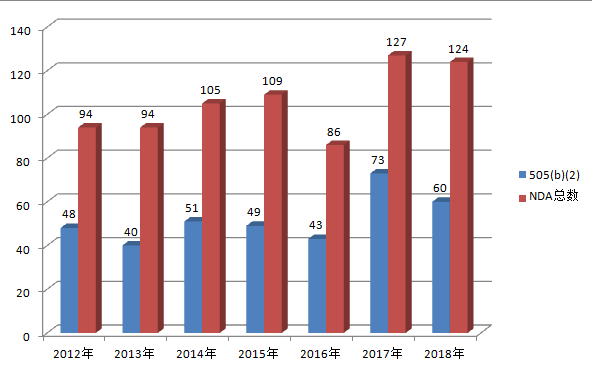
近年来,FDA505(b)(2)申报越来越受业界关注和青睐。从FDA发布的数据我们可以看到:近几年505(b)(2)的申报数量明显增多,其中2012年、2017年,以505(b)(2)方式获批的数量甚至已经超过了获批NDA总数的一半(见图)。下面我们主要从505(b)(1)和505(b)(2)的区别、国内外505(b)(2)申报的典型事例来具体介绍一下505(b)(2)申报的相关情况。
图 2012-2018年FDA获批的NDA数目统计(数据来源:FDA官网)
505(b)(1)和505(b)(2)的区别
505(b)(1)和505(b)(2)虽然都属于新药申请(NDA),但二者有诸多不同之处:
适应的类型
505(b)(1) 适用于新分子实体(NCE)。
505(b)(2) 适用于新分子实体(NCE)以及已批准药物的改变。505(b)(2)适用于改良型新药,因此采用505(b)(2)路径申请最多的是已批准药物的改变,包括适应证、配方、剂型、给药途径、用药方案等。
数据资料的提交
505 (b)(1)需要提供完整的临床前数据和临床安全性和有效性数据报告。
505 (b)(2)可部分依赖和引用已发表的文献以及并非由申请者开展的研究,用于支持申请所需要的安全性和有效性证明。可能包括临床数据,但是有时可能只基于生物利用度数据。
研发时限及其它
从大量的临床前研究及临床研究的时间来看,505 (b)(2)可以通过参考已发表的文献以及并非由申请者开展的研究,用于支持药物申报所需要证明的安全性和有效性。这样可以省去一些重复的实验,节约大量的时间和金钱,投入回报率较高。正因为如此,505 (b)(2)已成为诸多医药企业的新药开发策略之一。
另一方面,FDA共有4种新药加快审评方式:快速通道( Fast Track)、突破性疗法通道(Break Through)、优先审评(Priority Review)以及加速审批(Accelerated Approval)。对于一个新分子实体,通过505 (b)(1)途径可以获得FDA这四种加快审批的机会更多,这样在审批时间上也可能与505(b)(2)相差不多甚至更快,这是505 (b)(2)的局限性之一。另外,药品采用505 (b)(2)途径申请还可能存在因专利问题被耽误等局限性。505(b)(2)申请必须包含《美国联邦法律》第21条(21CFR)中所要求的专利证明(Patient Certification),并提前告知专利持有方;采用505(b)(2)途径申报的药品很多时候还需要额外的试验和数据来支持对药物改变。
505(b)(2)的典型案例
改变剂型的案例
美国强生公司的利培酮属于采用这一申报途径的典型案例。利培酮由美国强生公司研发,用于治疗急性和慢性精神分裂症。为拓展利培酮的生命周期,强生对其共进行了6步升级:利培酮常规制剂(片剂)、利培酮速释制剂(口崩片、口服液)、长效注射剂(Risperdal Consta)、代谢产物的缓释制剂(Invega)、代谢产物前药的长效注射剂(Invega Sustenna)、代谢产物前药的超长效制剂(Invega Trinza),通过升级逐步延长了产品生命周期。在利培酮常规制剂面临专利悬崖时,美国强生通过努力,使得改良型利培酮产品带动利培酮系列产品持续增长。
改变适应证的案例
格隆溴铵(Glycopyrrolate)由诺华公司开发,用于术前麻醉或插管过程中减少胃部和静脉分泌物。通过505(b)(2)申报途径,研究者在原先药物基础上开发出新的液体制剂,用于治疗罕见病脑性瘫痪。除此之外,该药物还被开发成多种剂型的长效毒蕈碱受体拮抗剂 (LAMA), 用于治疗慢性阻塞性肺病(COPD)。
改变给药途径的案例
Synera为美国ZARS公司开发的加热局部贴片,在2005年由FDA批准上市,主要用于浅表静脉通路的镇痛、浅表皮肤切除术、电流干燥手术、皮肤刮除活检的麻醉等。Synera的成分为利多卡因和地卡因,二者的剂量均为70mg,其中利多卡因是早已批准的局部麻醉经典用药;而地卡因是之前FDA未正式批准的外用局部麻醉剂。Synera则是两种局部麻醉剂的组合,适用于完整皮肤。FDA在审评时依据的是已公开文献、临床安全性和有效性研究数据,并要求申报方提供了药物代谢动力学数据。
新配方的案例
2015年,FDA批准Allergan公司的Avycaz上市。Avycaz是头孢他啶和新型β-内酰胺酶抑制剂阿维巴坦的复方制剂。阿维巴坦是新分子实体,针对丝氨酸为活性位点的β-内酰胺酶抑制剂,而头孢他啶则是第三代头孢类抗菌素。FDA同意企业可用头孢他啶之前的安全性和有效性数据申报,并要求递交非临床数据、I期和Ⅱ期临床数据。因阿维巴坦难以开展单方研究,故主要是提供受试者服用复方制剂后的数据,并通过开展体外和动物模型研究,确定添加阿维巴坦后头孢他啶对非敏感细菌的活性作用。
国内企业对505(b)(2)申报途径的积极探索
2019年第四季度,百济神州的泽布替尼和石药集团欧意药业的马来酸左旋氨氯地平获得FDA的新药上市申请批准,实现了国内NDA申报的突破。
基于505(b)(2)途径的便利性,目前国内还有一些企业在积极尝试505(b)(2)申报途径。
比如绿叶制药,其征战FDA的产品注射用利培酮缓释微球(产品编号:LY03004),申报新药选择的是505(b)(2)路径。在完成I期临床试验后,绿叶制药与FDA进行多次讨论沟通,2015年9月FDA正式确认利培酮缓释微球注射剂(Rykindo)不需要再进行临床试验,可在美提交新药NDA申请。
据了解,绿叶制药通过505(b)(2)途径申请的药品还有:治疗帕金森病的注射用罗替戈汀缓释微球、用于治疗前列腺癌的注射用醋酸戈舍瑞林缓释微球和治疗精神分裂症和分裂情感性障碍的帕利哌酮缓释混悬肌肉注射剂等产品。
据媒体报道,厦门力品药业的创新制剂新药盐酸帕洛诺司琼口腔黏膜,目前也在通过505(b)(2)路径向FDA申报。这是我国首个在国际上获批临床的口腔黏膜剂型。该产品临床用于治疗癌症患者化疗引起的呕吐,通过口腔粘膜吸收,解决了癌症化疗患者呕吐且口服用药困难问题。
浙江创新生物有限公司是浙江医药股份有限公司旗下全资子公司。2014年7月8日PIND会议期间,创新生物注射用盐酸万古霉素项目以505(b)(2)途径进行新药NDA申报,获得美国FDA的同意。2016年9月15日,创新生物同FDA ETT(Emerging Technology Team)团队在美国总部就创新生物的新技术进行了面对面会议,期间FDA ETT团队表示对创新生物的无菌连续生产技术具有极大的兴趣,随即提议希望通过POV(Pre-operational Visit)方式更深入地对该项新技术进行考察。POV考察期间,双方就注射用盐酸万古霉素项目无菌喷雾干燥、无菌粉体转移及灌装的新技术和新工艺进行了全面、深入且细致的讨论。
通过以上数据和汇总分析,我们可以看到,对于想积极拓展美国市场的中国企业,需要深入研究美国法规和指南,根据自己产品特点,选择合适的途径,更有效地利用已有科学资源,这样可以起到事半功倍的效果。同时,国内企业还需要持续加强质量体系建设,强化GMP水平的提高,这样有助于产品在美国市场的注册。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:安慧娟)
分享至
右键点击另存二维码!
-
为你推荐