真实世界证据为罕见病及中药研发带来新机遇
- 2020-02-26 13:04
- 作者:涂宏钢
- 来源:中国食品药品网
1月7日,国家药监局发布2020年一号文件——《真实世界证据支持药物研发与审评指导原则(试行)》(以下简称《指导原则》),该文件的发布预示着我国药品研发与评价将步入新阶段。
如该《指导原则》所言,随机对照临床试验(RCT)一般被认为是评价药物安全性和有效性的金标准,但其研究结论外推于临床实际应用时可能会面临挑战,也可能存在传统药物临床试验难以实施或者成本高昂等问题。近年来,如何利用真实世界证据评价药物的有效性和安全性,成为国内外药物研发和监管决策中日益关注的热点问题。
《指导原则》明确提出:把真实世界证据应用于支持药物监管决策,涵盖上市前临床研发以及上市后再评价等多个环节。例如,为新产品批准上市提供有效性或安全性的证据;为已获批产品修改说明书提供证据,包括增加或修改适应证,改变剂量、给药方案或给药途径,增加新适用人群,增加实效比较信息,增加安全性信息等;作为上市后要求的一部分支持监管决策的证据等。
这些涵盖范围和要求,为一些领域的疾病和药物的临床试验和监管决策给出指导性方向。罕见病、儿童药、中药院内制剂研发将接受真实世界证据。
罕见病及重大疾病用药:注册上市将提速
很多国外已获批的罕见病药物未能进入中国,很重要的原因就在于临床试验很难完成。传统的临床试验需要一个试验组和一个对照组。针对某些罕见病的临床试验,由于病例稀少导致招募困难;针对某些缺乏有效治疗措施的危及生命的重大疾病,随机对照试验往往存在伦理问题。现在,以上两种情况可以考虑以自然人群队列和专病队列形成的真实世界数据作为外部对照的基础。
《指导原则》“真实世界证据支持药物监管决策”部分明确指出,常见的为新药注册上市提供有效性和安全性证据的真实世界研究有:使用真实世界数据获得的结局或安全性数据的随机临床试验,包括实用临床试验(PCT,介于RCT和观察性研究之间的一种研究)设计等;以及针对某些缺乏有效治疗措施的罕见病和危及生命的重大疾病,而采用基于真实世界证据作为外部对照的单臂临床试验。
这无疑会大大减轻药企的成本,加快罕见病新药在国内的注册上市。
儿童用药:支持适应证人群扩大
对于已经上市的药物,新增适应证通常情况下需要RCT支持。但当RCT不可行或非最优的研究设计时,采用PCT或观察性研究等生成的真实世界证据支持新增适应证可能更具可行性和合理性。
《指导原则》也明确提出,在儿童用药等领域,利用真实世界证据支持适应证人群的扩大也是药物监管决策可能适用的情形之一。
中药品种:新路径新发展
部分中药院内制剂在临床存在安全性信息有限、疗效结论外推不确定等多项不足。但由于历史数据缺失、临床研究不足等因素,无法进行全面的临床评估。
现在国家药监局指明,真实世界证据可用于支持名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发。《指导原则》指出:对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
这给院内制剂的发展又提供了新的机会。因为如果按照传统新药申报做院内制剂临床试验,仅数千万成本与数年时间,对医疗机构而言就是巨大的挑战。《指导原则》发布后,医疗机构可以采用真实世界证据开展研究,这对一些有临床疗效的院内制剂,确实是一个利好。
应用真实世界证据支持已有人用经验中药的临床研发策略可以有多种,例如可以探索将观察性研究(包括回顾性和前瞻性)代替常规临床研发中I期和/或II期临床试验,用于初步探索临床疗效和安全性;在观察性研究的基础上,再通过RCT或PCT进一步确证已有人用经验中药的有效性,为产品的注册上市提供支持证据。如果经过评价,存在适用的高质量真实世界数据,且通过设计良好的观察性研究形成的真实世界证据科学充分,也可与药品监管部门沟通,申请直接作为支持产品上市的依据。
对于中药,用观察性研究代替I期、II期研究,提出研发路径,弥补历史数据的缺失。
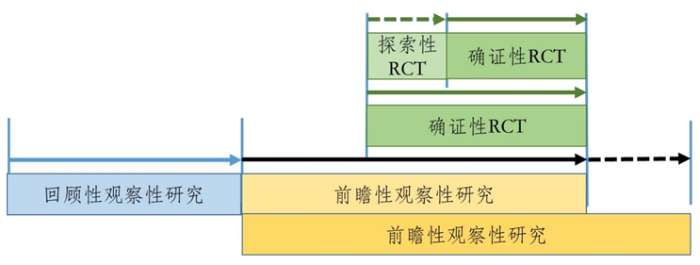
对于观察性研究与RCT或PCT研究如何相结合,国家药监局列举了两种已有人用经验中药临床研发的路径,但不限于此,其实现也可以有多种路径。(见图1、2)
路径一:
路径二:
图2 已有人用经验中药临床研发的路径之二
行业发展:大数据领域直接获益
《指导原则》规定了真实世界数据的十大来源,包括:卫生信息系统(HIS)、医保系统、疾病登记系统、国家药品不良反应监测哨点联盟(CASSA)、自然人群队列和专病队列数据库、组学相关数据库、死亡登记数据库、患者报告结局数据、来自移动设备端的数据、其他特殊数据源。
从这些数据来源可以看到,医疗大数据将直接获益。医疗数据库对于真实世界证据的重要性毋庸置疑。其中第九个来源为移动设备端数据,具体包含应用医用移动设备(如可穿戴设备)检测受试者获得的相关数据。这意味着,在未来数据规范化的前提下,除了官方各种信息数据系统外,移动设备端医疗数据也会成为真实世界证据的一个重要来源,这对于一些主打慢病管理的医疗器械设备厂商来是一大机遇,同时也将利好一批互联网医疗企业,这都可以有效降低药企的临床研究数据采集成本与执行成本。
然而,面对庞杂的大数据,用什么方法来保证数据的完整性和相关性,以及结果的可靠性,这些具体的问题需要在实践中不断总结。
可以肯定的是,《指导原则》与ICH相结合,必将加快我国在全球临床数据互认方面的进程,极大提高国外创新药的引入与原有产品新适应证的获批速度。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:安慧娟)
分享至
右键点击另存二维码!
-
为你推荐