各国新药上市“加速通道”了解一下?
- 2020-05-06 11:02
- 作者:陈倩
- 来源:中国食品药品网
中国食品药品网 3月30日,新修订《药品注册管理办法》正式出台,并将于7月1日起施行,届时中国沿用了13年之久的2007年版《药品注册管理办法》将同时废止。值得关注的是新修订《药品注册管理办法》中也是首次将一下四大“加快审评审批”通道纳入。
突破性治疗药物程序:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以申请适用突破性治疗药物程序。
附条件批准程序:药物临床试验期间,符合以下情形的药品,可以申请附条件批准:①治疗严重危及生命且尚无有效治疗手段的疾病的药品,药物临床试验已有数据证实疗效并能预测其临床价值的;②公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的;③应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的。
优先审评审批程序:药品上市许可申请时,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:①临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;②符合儿童生理特征的儿童用药品新品种、剂型和规格;③疾病预防、控制急需的疫苗和创新疫苗;④纳入突破性治疗药物程序的药品;⑤符合附条件批准的药品;⑥国家药品监督管理局规定其他优先审评审批的情形。
特别审批程序:在发生突发公共卫生事件的威胁时以及突发公共卫生事件发生后,国家药品监督管理局可以依法决定对突发公共卫生事件应急所需防治药品实行特别审批。对纳入特别审批程序的药品,可以根据疾病防控的特定需要,限定其在一定期限和范围内使用。
通过设立“加快通道”,加速符合特定条件的药品上市,在欧美日国家的药品监管机构也都有类似措施。
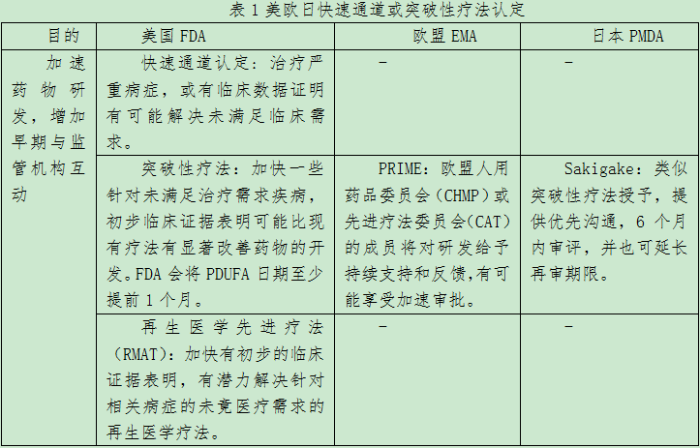
早期药物研发加速:快速通道或突破性疗法认定
快速通道认定Fast track designation:目前仅在美国FDA有这一认定资格,在1997年FDA《现代化法案》中正式提出,制药公司可以在任何阶段甚至临床前阶段提出认定申请,FDA有60日的回应期,并可以选择滚动提交数据,可以实现与监管部门更早和更频繁的沟通。但最后数据提交后并不直接享受其他的“加快通道”,仍予以标准审评。
突破性疗法认定Breakthrough therapy designation:美国、欧盟、日本都有相关政策。美国的突破性疗法认定是在2012年FDA《安全与创新法案》中提出,药企可以在IND申请后任何时间提出申请,也具备快速通道流程和优先审评的资质。但是,如果在接下来的临床试验中,相关药品并没有显示出和之前认为的同样的前景,则可以撤销突破性疗法认定,并且不会给予优先审评。类似的,欧盟在2016年推出了优先药物计划(Priority Medicine,PRIME),药企申请必须递交早期临床数据, EMA会在40日内作出回应。多学科专家组会组织启动会议 (‘kick-off’ meetings)是PRIME的一个关键特征,会议会以确保药物生命周期的各个方面尽早讨论。
先驱政策(Sakigake)是日本在 2015 出台的,除与美国突破性疗法认定类似外,还有一个主要要求:计划在日本首先提交或在日本和其他国家地区同期提交上市申请,日本政府也愿意为获得上市许可的Sakigake药物补贴 10% 至 20% 的溢价。
再生医学先进疗法认定(RMAT):美国FDA在2016年《21世纪治愈法案》提出针对包括基因疗法、细胞疗法等在内的再生医学疗法的RMAT,在获得认定后也包括快速通道与突破性疗法认定的所有优惠措施,包括与FDA的早期互动等。
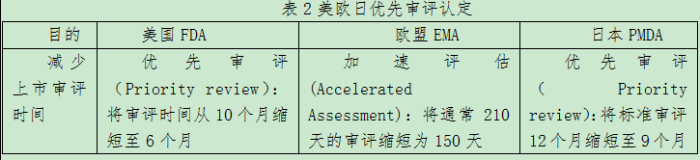
缩短上市审批时限:优先审评认定及优先审评凭券
在欧美日三个国家地区都对药品的上市申请有优先审评认定制度,必须满足:与现有疗法相比,有显著改善严重或危及生命疾病的治疗、诊断或预防的相关药品,还可以针对特定治疗领域(例如,具有抗传染病资质的产品或针对某些儿科适应症的标签扩展),或美国FDA还包括针对罕见热带病或罕见儿科疾病药物开发的“优先审评凭券”所认定的优先审评。当药品获得优先审评时,不可避免地占用审评资源,可能会减慢其它药品的审评速度。因此优先审评凭券持有者,需要向FDA支付额外的费用。但这一“优先审评凭券”可以出让,出让价格曾创下3.5亿美元的记录。
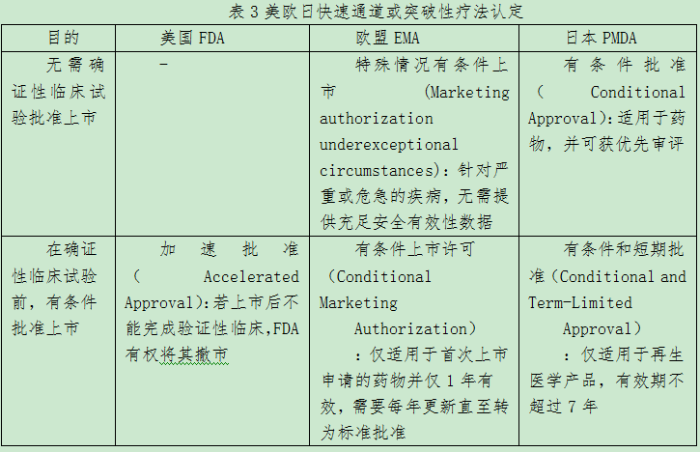
上市决定性审批:加速或有条件批准上市
欧美日加速或有条件批准上市主要有两种类型:一是无需确证性临床试验数据即可批准上市,当疾病本身致死或没有标准疗法,因而药企无法提供完全的临床试验数据等特殊情况时,目前仅在欧盟和日本监管部门有这一政策,日本对上市后需进行监管或临床试验有要求,目前美国没有这一政策;二是在能提供确证性临床试验数据前可批准上市,但需要开展验证临床获益的上市后研究,与欧美不同的是,日本这一政策仅适用于再生医学产品。多数情况下,加速批准可基于单臂I或II期采用替代终点的试验,例如采用“无进展生存期”获批的肿瘤用药,必须在上市后临床试验中证明“总生存期”确实获得改善,若未能验证,FDA可以撤销批准,撤销批准有过先例。其中截至2017年,有5个抗肿瘤药适应症曾被撤销加速批准,包括安维汀(Avastin,通用名:bevacizumab)曾在2008年12月获加速批准用于与紫杉醇联用于HER2阴性转移性乳腺癌,但最终确证性试验没有显示总生存获益,而在2011年11月撤销批准。
孤儿药资格认定
除了以上的“加快通道”,对于罕见病用药,即孤儿药的研发,欧美日相关政策手段和激励措施类似,分别从法律保障、行政制约、税收激励、经费补助等角度制定和实施,但基于国情的不同,产品独占权的年限、补贴种类和计划存在差异。与欧美不同的是,日本政府采取政策直接干预孤儿药的生产、销售和定价。

2017年,我国药监机构加入国际人用药品注册技术协调会(ICH)后,新修订《药品注册管理办法》出台,中国也有了自己的四种"加快审评审批"通道,在面临全球生物制药新技术和同步开发的挑战和风险时,审评部门会与制药企业尽早沟通和介入审评,为中国新药开发作指导,最终可以使救命救急的好药尽快让患者获得。(陈倩)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













