《中国药典》2020年版一部导读
- 2020-08-31 10:20
- 作者:
- 来源:《中国药品标准》杂志
药品应当符合国家药品标准,《中华人民共和国药典》(以下简称《中国药典》)是国家药品标准的重要组成部分与集大成者,是药品研制、生产(进口)、经营、使用和监督管理等相关单位均应遵循的法定技术标准。《中国药典》不仅是药品质量控制和保障公众健康的有效工具之一,同时对规范行业秩序、引导产业发展等方面都具有重要作用。
按照习总书记提出的关于药品监管工作“四个最严”要求以及《中共中央 国务院关于促进中医药传承创新发展的意见》(以下简称《意见》)的精神,按照《<中国药典>2020年版编制大纲》(以下简称《大纲》)确立的工作目标和任务,完成了《中国药典》2020年版(一部)的编制工作。
1 标准的认知和理念发生深刻变化
随着科学技术及认知水平的发展,“标准”概念的定义也逐步发展,但其目的都是为了获得最佳秩序和共同效益。因此,中药标准的发展在为监管服务的同时,也是中药产业健康发展与满足人们用药需求的重要保障之一。“最严谨的标准”要求标准设置的项目科学、限度合理,是以严谨的科学研究、严谨的标准工作与审议程序来实现的,是以标准的科学性、合理性、实用性与适用性来体现的。
1.1 标准的安全性导向作用进一步加强
《意见》就“加强中药材质量控制”要求“严格农药、化肥、植物生长调节剂等使用管理,分区域、分品种完善中药材农药残留、重金属限量标准”,《大纲》“各部重点工作”中亦已在安全性方面进行了系统规划。
《中国药典》2020年版修订了“0212药材与饮片检定通则”(四部),规定植物类药材及饮片禁用农药(33种禁用农药)不得检出,并在“2341 农药残留量测定法”中新增第五法“药材及饮片(植物类)中禁用农药多残留测定法”;修订“9302中药有害残留物限量制定指导原则”,新增第五项“中药中重金属及有害元素一致性限量指导值(植物类)”。
1.2 标准的实用性与适用性进一步加强
《中国药典》2020年版稳步推进药典品种收载,进一步满足了国家基本药物目录和基本医疗保险目录品种的需求。针对目前中药标准中存在的问题,国家药典委员会从立项开始即广泛采纳社会各界意见和建议,以中医临床需求与质量标准问题为导向,以建立科学、可行的标准为目标开展制修订工作。在按规定的程序进行标准制修订工作外,还通过宣贯培训、企业交流、专家咨询、媒体引导等多种渠道加强沟通交流,促进各层面标准理念的融合,回应社会关切,推进药品标准工作的贯彻落实。
1.3 标准的研究结果与产品实际进一步吻合
标准以科学研究与实践经验为基础,而对于本身疗效多依赖于实践经验的中药,目前科学研究尚难以全面揭示其作用机制,物质基础的现代研究还有待深入。因此,现阶段药材与饮片质量标准中用于日常检验的相关项目的制修订实际上可分为三个部分:基于本草考证与现代应用实际的来源规定(包括基原、部位、加工方式等);基于来源正确的代表性样本“辨状论质”的性状规定;基于“辨状论质”合格的代表性样品建立的以相关物质与结构为依据的鉴别特性(包括显微结构,物质的光谱特征、色谱属性,浸出物、水分、灰分等相关检查,指定成分含量等),这也是近二三十年来《中国药典》中药标准体系发展的客观趋势。植物油脂和提取物、成方制剂和单味制剂质量标准,则是各药味相关质控项目在制备过程转移规律的体现。而随着质量控制需求与标准项目设置相辅相成不断发展,《中国药典》中药质量标准成为一个整体的标准体系,其中设置的各项内容对中药的质量控制和保障临床用药安全有效均有其特有的目的与意义。
同时,根据马克思主义认识论“以科学的实践观为基础的能动的反映论”,基于科学研究之实践经验,标准制修订工作中,通过编制大纲、课题立项等发挥能动性,对中药标准的专属性、特征性提出更高的要求;而限于现阶段的认知水平与检测体系整体能力,对相关规律的科学研究无法一蹴而就。例如饮片炮制研究,决不能因为一时显示不出所用的实验指标的变化,就轻率地否定炮制的意义和作用。由这些可控和不可控因素,共同决定了现阶段中药质量标准的水平,体现出标准是现阶段科学认知与实践经验的平衡。
2 主要增修订内容和特点
《中国药典》2020年版一部共收载标准2711个,其中新增117个,直接修订452个,不再收载4个。主要在以下几个方面进行了增修订。
2.1 全面提升安全性控制水平
如表1所示,在控制具潜在风险的外源性有害物质方面:完善“中药有害残留物限量制定指导原则”及相关方法;对于植物类药材及饮片,制订了33种禁用农药残留限量规定,建立了重金属及有害元素的指导限度;制订了易霉变中药材与饮片真菌毒素限量标准。

在控制内源性毒性成分方面,开展了中药中所含成分与肝肾毒性的毒-效关系研究,对于具有较高潜在风险的中药品种则不再收载。另外,还立项开展了乌头碱等毒性物质相关研究,为其限量标准的制定提供了毒理学(生物学)数据支撑。
2.2 进一步完善以中医临床为导向的中药质量控制技术体系
2.2.1 来源表述规范化
中药几千年的临床应用实践积累了大量经验与智慧,重点体现在历代本草和文献上,结合本草考证,在不引起用药混乱的情况下,根据植物、动物、矿物分类学等领域中被广泛认可的研究成果,对部分品种来源项目中中文名称、拉丁学名等进行了规范化修订,如表2所示。
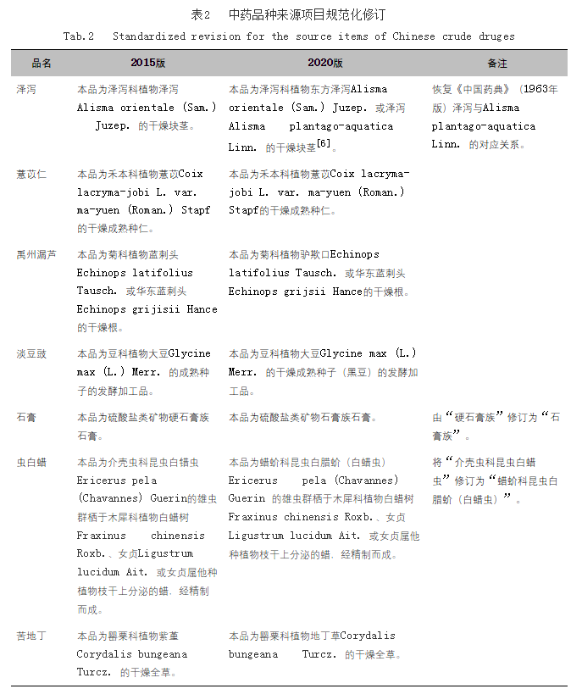
2.2.2 完善饮片质量标准体系,突出中医药特色
饮片是中医临床用药的主要方式之一,《中国药典》2020年版进一步完善了饮片质量标准体系。对于饮片炮制项为净制、切制的,经过对性状、鉴别、检查等项目的系统研究,逐步完善;对于经炮炙或其他处理后的饮片,在科学研究的基础上,进一步加强专属性质量控制,突出中药炮制“生熟异治”的传统特色。《全国中药饮片炮制规范》的编制工作也在稳步推进中。
例如:金银花 金银花功能清热解毒,现代药理研究证明金银花中环烯醚萜苷类成分具有保肝利胆、抗炎镇痛、解热、抗病毒等作用,因此在新版药典标准中增加环烯醚萜苷类成分控制的特征图谱项目。
酒女贞子 根据酒女贞子炮制过程中特女贞苷转化为红景天苷的特点,将酒女贞子饮片标准中含量测定指标成分改为红景天苷,反映出所控制成分与炮制的相关性,体现中药特色。
熟地黄 原标准中地黄、熟地黄均有毛蕊花糖苷的含量测定限度要求,但毛蕊花糖苷含量在地黄中仅为万分之二左右,且在炮制过程中极不稳定,易发生降解和转化。针对此问题,通过立项研究,并与国家评价性抽验工作相结合,以具有滋阴、补血及降血糖活性且含量较高、性质更稳定的地黄苷D[8]代替毛蕊花糖苷作为地黄和熟地黄的含量测定指标。
炒苦杏仁 通过炒苦杏仁炮制机理的验证,发现炒苦杏仁是通过炒制产生苦杏仁苷异构化反应,炒后D-苦杏仁苷、L-苦杏仁苷总量虽与燀苦杏仁基本持平,但D-苦杏仁苷含量明显升高,L-苦杏仁苷下降,与临床报道D-苦杏仁苷作用强于L-苦杏仁苷相符合。故将炒苦杏仁饮片标准中苦杏仁苷含量限度提高到与燀苦杏仁一致,即不得少于2.4%。
另外,依托相关立项研究,起草了“中药材品种收载指导原则”“增收中药饮片指导原则”等指导原则,相关内容拟收入再版的《国家药品标准工作手册》。
2.3 以问题为导向提高标准的实用性与适用性
根据《大纲》中“提高中药标准应对质量问题的能力”的要求,针对存在问题的典型品种开展专项研究,解决相应标准中存在的问题。
2.3.1 药材和饮片
例如:半夏 通过调研,发现部分生产厂家在产地初加工过程将焦亚硫酸钠拌入半夏中,目的是提高半夏药材的浸出物。为保证半夏药材质量和安全性,通过收集未经伴有焦亚硫酸钠的97批样品开展研究,修订了浸出物的限度。《中国药典》2015年版中半夏以琥珀酸计算总酸含量,测定方法为电位滴定法,但该方法滴定终点判定难度大,导致滴定结果误差较大,专属性不强。通过研究发现,半夏所含有机酸以草酸为主,琥珀酸不足总有机酸含量的10%,琥珀酸不能够代表总有机酸的含量,且半夏经硫磺熏蒸后总有机酸的含量(电位滴定法测定)升高,存在产地加工通过硫熏提高总有机酸含量的现象。这些成分与半夏的质量和疗效相关性不强,有机酸是否有必要作为半夏的质量控制指标,还有待商榷。故经专家审议,删去了总酸的含量测定项目。清半夏由半夏药材加工而来,一并进行了相应的修订。
广陈皮 针对广陈皮按原标准含量测定项目(含橙皮苷不得少于3.5%)难以达标问题,经系统研究审议,拟对广陈皮单独制定含量限度要求(含橙皮苷不得少于2.0%;含川陈皮素和橘皮素的总量,不得少于0.42%)。
淫羊藿 针对相关单位反映的淫羊藿含量问题,通过大量的产地调研和文献档案查阅,在充分收集样品、科学研究、专家论证基础上,恢复饮片炮制需“摘取叶片”使用的规定(即《中国药典》2005年版的炮制要求),并根据不同植物来源制订了不同的含量限度。
连翘 对于“青翘”与“老翘”的问题,通过本草考证说明二者在本草中均有记载和使用,不存在孰优孰劣的表述,根据代表性样本的研究结果,就相同的含量测定指标分别制订了不同的限度要求。
2.3.2 植物油脂和提取物
丹参总酚酸提取物 针对丹参总酚酸提取物标准中含量测定规定最低限度值仅为5.0%,将此品种名称改为“丹参水提物(丹参总酚酸提取物)”。
银杏叶提取物 采用中药指纹图谱等技术手段从整体上评价中药质量。针对银杏叶提取物不同批次间的质量差异,分别建立了HPLC和UPLC指纹图谱方法,以“供试品指纹图谱中应呈现17个与对照提取物指纹图谱相对应的色谱峰,其中6号峰与参照物峰保留时间相对应;全峰匹配,按中药色谱指纹图谱相似度评价系统计算供试品指纹图谱与对照提取物指纹图谱的相似度,应不低于0.90”的要求来控制银杏叶提取物的质量。
2.3.3 中成药
相对于中药材与饮片,中成药生产链长、风险点多,中药材与饮片本身就是一个含有多种成分的复杂体系,而由其组成的中成药则更为复杂。这在客观上决定了中成药质量标准必须抓住主要矛盾,兼顾次要矛盾:重点关注中成药中的君臣药或贵细药,同时控制与制备工艺等过程相关的指示性项目。
例如:板蓝根颗粒 板蓝根颗粒现有批准文号800余个,相关生产企业700余家。依托前期国家评价性抽验研究成果,发现不同厂家之间产品质量参差不齐。特别是(R,S)-告依春的含量,其主要原因是该成分易升华散失而导致在板蓝根颗粒中含量下降。因此,考虑到该成分的控制不仅是对原药材与生产工艺的控制,也是对包装材料与储藏条件的控制,在标准中新增以(R,S)-告依春为对照品的色谱鉴别项目,和以尿苷、鸟苷、腺苷总量计的含量测定限度规定。
牛黄解毒片 牛黄解毒片收载于医保目录和基本药物目录,生产厂家众多,属于临床需求量大的重点品种,在《中国药典》2015年版中该品种标准收录了5个薄层鉴别项目用以鉴别其中5个药味或有效成分(冰片、胆酸、大黄、人工牛黄、黄芩),需要分别制备5份供试品用于相应的鉴别项目,还用到了大量的三氯甲烷。新版标准对鉴别方法进行了简化,仅需取样一次,按不同极性分步提取处理,就可以在3个项目中达到同样的鉴别效果,既简化了操作,提高了检测效率,又以替换毒性较高的溶剂并减少用量来体现药品标准绿色环保的理念。
2.4 稳步推进成方制剂和单味制剂质量标准
加强中成药标准控制项目与中医临床相结合,加强专属性质量控制,充分体现中医药特点。
2.4.1 按照大纲要求,开展中成药品种的遴选工作
《中国药典》2020年版拟增加的品种,大部分从国家标准提高课题中产生,也有一部分来自企业自主研究后的申请。新增品种中,处方药味涉及含野生濒危动植物、化石类、人类胎盘类、动物粪便类等的中成药,不再收入药典。
2.4.2 完善和规范中成药标准体系(包括处方公开)
依照《中华人民共和国标准化法》“强制性标准文本应当免费向社会公开”,中成药处方对指导医师用药、满足消费者知情权等方面具有积极作用,对于药典已收载的非国家保密品种,按照大纲要求和专业委员会讨论,除涉及国家秘密技术项目品种外,公开处方、制法。采取先在外网上公开品种名单,再公开档案中查到的处方、制法,请相关生产企业核对,最后在《中国药典》2020年版相关标准中填补内容的做法,将251个处方、制法内容在标准中补充完善。
2.4.3 规范中成药的制法
制法不同于生产工艺,是对关键工艺步骤的浓缩。对于标准中制法项目的修订,一贯采取审慎的态度,经制剂专家审议,对于申请修改的,通过相关研究证明确实属于没有质的变化的,如制粒前浓缩相对密度的明确、药材粉碎等,同意修订。
2.4.4 加强控制项目与中医临床相结合,充分体现中医药特点
以冠脉宁胶囊为例,其为国家医保目录品种,是治疗心血管疾病的中成药,多厂家生产,其中丹参和葛根是活血化瘀的主要药味,丹参中的丹酚酸B和葛根中的葛根素是主要的有效成分,新版药典建立了同时测定丹酚酸B、葛根素的含量测定方法,将质量标准控制指标与中医临床功效相结合,以体现质量标准与中医临床相结合的标准制修订思路。
3 药典编制的思考与启示
3.1 要以发展的眼光看待标准体系的建设
完善以《中国药典》为核心主体的符合中医药特点的中药标准体系,必须认识到中药的资源依赖性及随之而来的品质波动,以及多元化资本进入中药产业所带来的正负两方面的相关问题。近几十年及未来十年二十年内,在中药野生资源紧缺、人工种植养殖模式仍有待规范化的大前提下,现阶段中药品质与质量要求、质量标准之间的矛盾将一直存在。这就要求对于中药标准,应传承实践经验规律总结下的质量核心,以物质基础科学研究为佐证发展创新,中药质量标准和标准体系仍需要不断完善和提高,标准体系的建设依然任重而道远。
3.2 重金属及有害元素、禁用农药残留的要求应循序渐进
农药残留、重金属及有害元素问题一直是中药被“诟病”的症结之一。《农药管理条例》规定“剧毒、高毒农药不得用于中草药材的生产”,农业部的相关公告中亦不时增补中草药作物禁用农药名单,但从市场情况来看,中草药材大多属于小宗作物,禁用农药检出、重金属及有害元素超标时有发生,但由于属于农作物监管与药品监管重叠区而受到忽视。随着药品追溯体系的建立和发展,中药生产企业需要对中药源头进行质量控制,因此新版药典在通用技术要求中对植物类药材33种禁用农药限量做出规定,并提出重金属及有害元素的推荐限度,将有助于形成倒逼机制,使得企业更加重视中药材的种植、采收等,从源头把控好中药质量。
3.3 要正确认识标准对于药品质量控制的局限性
《中华人民共和国标准化法》定义“标准”是指有关领域需要统一的技术要求。就药品而言,药品应当符合药品标准,但是满足标准要求的不一定就是药品,这种辩证关系在《中国药典》凡例中亦有体现:任何违反GMP或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》未检出其添加物质或相关杂质,亦不能认为其符合规定。药品的质量受诸多因素共同作用与影响,具体来说,即是以合格的原辅料、经合乎规范的生产过程与储运条件而获得的具特定预期疗效的物质载体,而中药的复杂性与特殊性在于原辅料的质量转移甚至发生于不同的领域及层级。药品标准仅仅是对药品及原辅料合格与否的检定规定,不可机械地仅靠标准来替代对中药种植及生产全过程的完整控制。
3.4 要以严谨的程序保障标准化工作的公开透明
《大纲》“指导原则”中明确指出“着力突出政府在国家标准制定中的主导作用和企业在产品标准制定中的主体地位”,在“保障措施”中亦明确了“构建‘政府主导、企业主体、专家指导、社会参与’的药品标准工作新格局”。按照相关工作程序,国家药品标准的课题立项与标准制修订等均及时予以公示,征求社会各界意见。从近期相关反响来看,业界对标准的关注度不断提高:有关单位或个人就课题立项疑义的咨询,生产企业就新标准草案的复核验证意见与建议,相关社会团体、科研人员与医药爱好者等基于自身理解提出的许多建设性观点等等,其中有许多建议被采纳。同时,由于野生变家种、不规范种植、不合理采收等导致的质量问题仍有待系统研究,对于许多根据个别批次样本考察而提出的标准制修订建议则难以被采纳。需要特别说明的是,国家药品标准提高工作需要并且期望社会各界的参与,相关工作技术要求建议参照《国家药品标准工作手册》。
4 展望
中医药是中华民族的一个伟大宝库,其整体观念、辨证论治思维方式将继续造福于人类,中医药在新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)疫情防治期间发挥了重要的作用。但目前中药整体质量存在下滑的风险是一定时期内存在的问题,值得警惕。随着对中药相关科学技术研究的进一步深入,期望能够发现更多与疗效相关联的指标项目,为《中国药典》中药标准的不断完善和提高,为促进中药标准体系的不断完善与创新发展,奠定坚实的科学基础。(摘自《中国药品标准》杂志)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













