盘点10月份中美欧批准上市的新药
- 2020-11-10 10:00
- 作者:陈倩
- 来源:中国食品药品网
2020年10月,中国、美国和欧盟获批的新药数量不多,最受关注的还是美国批准上市的两个抗病毒新药。
美国
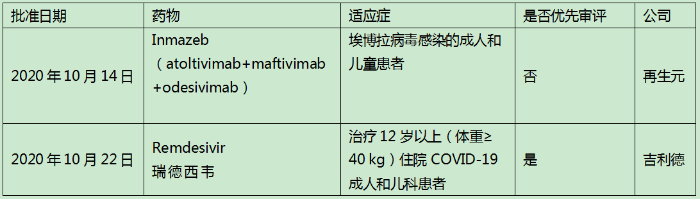
2020年10月,美国FDA批准两款药物上市,都是抗病毒新药——Inmazeb(atoltivimab+maftivimab+odesivimab)和Remdesivir。埃博拉病毒和COVID-19都是对人类公共卫生带来极大危害和破坏的病毒,这两款药都是世界上首个获批用于这两种病毒的治疗用药。
表1 2020年10月美国批准上市的新药
再生元的Inmazeb是由三种全人源IgG1单克隆抗体(atoltivimab、maftivimab、odesivimab-ebgn)组合而成的鸡尾酒疗法,三个抗体都具有相似结构,靶向结合于埃博拉病毒表面糖蛋白不同位点,通过阻断病毒的附着侵入、招募免疫细胞以感染细胞为目标来中和病毒。FDA批准基于一项III期试验, 681例患者随机平均分配接受4种疗法的治疗,包括抗体鸡尾酒疗法ZMapp、三抗鸡尾酒疗法Inmazeb(REGN-EB3)、单抗mAb114和瑞德西韦。
结果显示,28天时各组死亡率:MAb114组35.1%(61/174),ZMapp组49.7%(84/169),Inmazeb(REGN-EB3)组33.5%(52/155),瑞德西韦组53.1% (93/175)。Inmazeb治疗组在死亡率方面低于ZMapp和redesivir治疗组。安全性方面,常见的不良反应为寒战、发热、心动过速、呼吸急促、呕吐、低血压、腹泻和组织供氧不足。
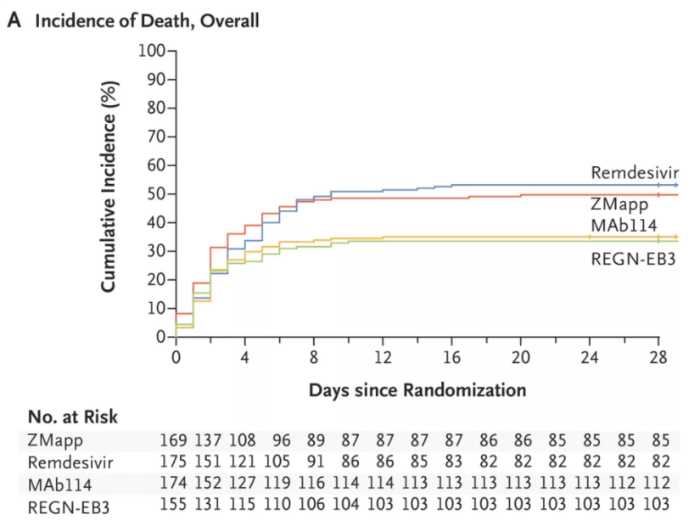
Inmazeb用于埃博拉病毒的III期临床试验结果。
瑞德西韦的研发进展一直备受关注,其在5月1日曾获得FDA的紧急使用授权(EUA)。此次获得FDA正式批准是基于三项随机对照试验,包括近期发布的美国国家过敏和传染病研究所(NIAID)的双盲、安慰剂对照Ⅲ期ACTT-1试验最终结果。据悉,瑞德西韦针对儿科患者的安全性和疗效临床试验正在进行中。
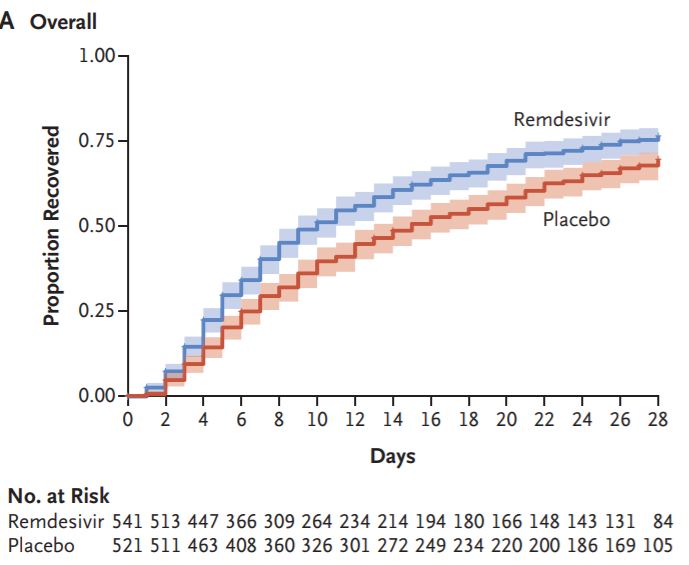
ACTT-1试验结果
欧盟
欧盟10月份批准了两款孤儿药上市,这两款药物此前都已经在美国获批上市。
表2 2020年10月欧盟批准上市的新药

诺华的Adakveo于2019年11月在美国获得全球首批,是第一个被批准可用于镰状细胞病患者预防VOC的靶向疗法,同时是第一个也是唯一一个被批准的通过结合P选择素(P-selectin)发挥治疗作用的靶向生物制剂。P-选择素是一种细胞粘附蛋白,在导致血管阻塞的多细胞相互作用中起着中心作用。通过与活化的内皮细胞和血小板表面的P-选择素结合,Adakveo可阻断内皮细胞、血小板、红细胞和白细胞之间的相互作用。
多年来,SCD仅有一种治疗性药物--羟基脲(Hydroxyurea),这种化疗药物能降低VOC 50%的发生率,但会引起严重的毒副反应,具有致癌风险,使用受到限制。此次批准基于一项名为SUSTAIN的II期临床研究,旨在评估Adakveo联用或不联用羟基脲预防SCD患者经历VOC的疗效和安全性。数据显示,与安慰剂相比,Adakveo(5mg/kg)将VOC中位年发病率显著降低了45.3%(1.63 vs 2.98,p=0.01),Adakveo组在治疗期间没有经历任何VOC的患者比例是安慰剂组的2倍以上(35.82% vs 16.92%,p=0.013)。
Insmed公司阿米卡星脂质体吸入悬液Arikayce于2018年9月在美国获得全球首批,也是目前唯一获批治疗MAC肺部疾病的药物,治疗由鸟型分枝杆菌(MAC)导致的非结核分枝杆菌(NTM)肺部感染。Arikayce是一种新型的、每日一次的、吸入用阿米卡星制剂,阿米卡星是一种针对多种NTM有治疗作用的氨基糖苷类抗生素,但需要静脉给药,因对听力、平衡和肾功能有严重毒性而使用受限,所以吸入悬液可以提高患者依从性。此次批准基于一项全球III期临床CONVERT,与标准治疗多药方案(MDR)相比,Arikayce联合MDR可显著提高痰培养转化率(p<0.0001),两组NTM肺病证据消除的患者比例分别为29%和9%。
中国
在中国,生物类似药的市场竞争在加速。9月信达生物的阿达木单抗生物类似药刚被批准,10月利妥昔单抗生物类似药获批,这是信达生物获批上市的第4个单抗类药物,前3个为信迪利单抗注射液、贝伐珠单抗生物类似药和阿达木单抗生物类似药,可见信达生物研发速度之快。
表3 2020年10月中国批准上市的新药

利妥昔单抗的原研是罗氏重磅炸弹药物美罗华,在中国第一个上市的利妥昔单抗生物类似药是复宏汉霖的汉利康,于2019年2月首次获国家药监局批准;2019年,复宏汉霖利妥昔单抗注射液销售额约为1.5亿元。国内开发美罗华类似物并注册申报的企业已经超过10家,包括三生国健、海正药业、正大天晴、华兰生物、丽珠单抗等。(陈倩)
数据来源:Pharmadigger数据库
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐