GVP逐条谈 | 21.药物警戒部门的职责
- 2021-07-26 14:06
- 作者:万邦喜
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》第三章 机构人员与资源
第一节 组织机构
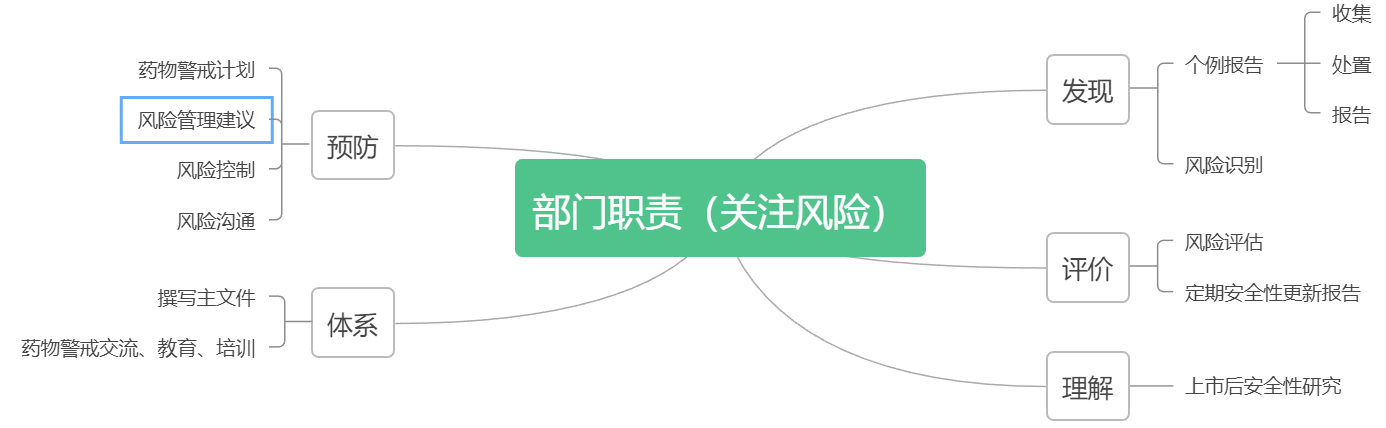
第二十一条 药物警戒部门应当履行以下主要职责:
(一)疑似药品不良反应信息的收集、处置与报告;
(二)识别和评估药品风险,提出风险管理建议,组织或参与开展风险控制、风险沟通等活动;
(三)组织撰写药物警戒体系主文件、定期安全性更新报告、药物警戒计划等;
(四)组织或参与开展药品上市后安全性研究;
(五)组织或协助开展药物警戒相关的交流、教育和培训;
(六)其他与药物警戒相关的工作。
【理解】
作为一个专门部门,有了部门名称(药物警戒部或其他名字)后,需要有对应的职责,以体现该部门的价值,并体现与其他人员/部门的联系。第二十一条的六款内容,初看似乎毫无逻辑,仔细梳理会发现其中的逻辑还是很清晰的。
第二十一条高度概括了药物警戒部门的几大职责,围绕着药物警戒的定义,以风险管理为目标,以体系为支撑点,可以看出药物警戒部门职责的内在逻辑。以下依据职责描述中的关键词,逐一进行解读。
·发现风险
药物警戒部门作为“中央情报局”,承担着各来源、各渠道的个例安全性报告的收集工作,并对这些报告进行标准化处理(处置),从而决定是否要向监管机构报告(递交),此为第(一)款中的内容。
从这一连串的工作中,其重点是从数据中发现风险,识别风险,此为第(二)款的内容,也是符合药物警戒模型是从“数据输入”到“行动产出”的过程。
·评价风险
当收集到一定量的个例报告后,需要对药品的风险进行评估,累积一定时间段的数据,撰写“定期安全性更新报告(PSUR)”,描述药品获益-风险,此为第(三)款中的内容。
注意,如为上市前产品,需要撰写研发期间定期安全性更新报告(DSUR),需结合后续GVP条款第123条理解。
·理解风险
药品的风险特性可能永远无法了解全面、透彻。因此,为了更广泛了解药品的安全特性,去发现一些临床试验期间尚未被监测到的安全隐患,去理解药品为何会出现不良反应,理解其发生机制,可以更好地避免或预防再次发生。
所以,对某些药品,除了常规的药物警戒活动进行监测外,还需要开展一些上市后安全性研究,可以由PV部门组织或参与,PV部门可对上市后安全性研究的方案的相关章节进行审阅。此为第(四)款中的内容。
·预防风险
基于对药品的安全特性的了解,制定药物警戒计划,此为第(三)款中的内容。开展常规或特定的药物警戒活动,提出风险管理建议,开展风险控制及风险沟通等活动,进一步预防风险的发生,真正达到药物警戒的终极目标——保护患者安全。此为第(二)款中的内容。
·体系管理
众所周知,药物警戒工作需要一套体系来支持,并需要对该体系进行不断完善和改进,从而保证其持续、有效、适宜、充分。而体系的呈现最终由药物警戒体系主文件(PSMF)来承载和呈现,药物警戒工作谁做的,做些什么,怎么做的,用什么工具和流程来支撑等等,如实地记录以上内容从而形成PSMF。此为第(三)款中的内容。
当然,整个药物警戒活动中最不可或缺的是“人”,因此需要持续地组织或开展关于药物警戒的交流、教育和培训,不仅仅是针对药物警戒部门的人员,还需要开展全员培训,对其他部门的相关人员如CRA或销售等做特定培训。
对于药物警戒部门的专职人员、药物警戒负责人可安排参加行业、监管机构组织的相关培训和交流,充分利用各类活动与业内专家、同行展开交流,互相取长补短。此为第(五)款中的内容。
【实践影响】
需要检查药物警戒部门的职责是否已描述清晰。关于药物警戒部门的职责描述,每家公司依据实际业务情况,基于GVP的概括描述,可增删,可详细,可概要,当然描述的越详细,对人员分工,人员岗位描述更有帮助,更有利于其他部门的人员增加对药物警戒部门的认识和理解,对开展工作有事半功倍之效。(浙江太美医疗科技股份有限公司药物警戒与法规合规事业部总经理 万帮喜)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

行政处罚裁量 | 不确定法律概念有了确定的范围——浅析《药品监督管理行政处罚裁量适用规则》
《裁量规则》对“初次违法”“危害后果轻微”“及时改正”“充分证据”“情节严重”等不确定法律概念进行了不同程度的细化、明确、缩窄范围,并对适用这些不确定法律概念需要注意的事项给予规范... 2024-04-23 14:07 -