每周医药看点(8.27-9.2)
- 2021-09-03 10:45
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家医保局联合八部门印发《深化医疗服务价格改革试点方案》;国家市场监督管理总局发布《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》;国家药监局决定对注射用磷酸肌酸钠说明书进行统一修订完善……8月27日-9月2日,医药行业的这些事情值得关注。
行业政策动态
1.国家医保局、国家卫生健康委、国家发展改革委、财政部、人力资源社会保障部、市场监管总局、国家中医药局、国家药监局印发《深化医疗服务价格改革试点方案》。方案指出,通过3至5年的试点,探索形成可复制可推广的医疗服务价格改革经验。到2025年,深化医疗服务价格改革试点经验向全国推广,分类管理、医院参与、科学确定、动态调整的医疗服务价格机制成熟定型,价格杠杆功能得到充分发挥。
2.国家市场监督管理总局发布《医疗器械注册与备案管理办法》和《体外诊断试剂注册与备案管理办法》,自2021年10月1日起施行。两个办法贯彻落实新修订《医疗器械监督管理条例》立法精神,从全面落实医疗器械注册人、备案人制度,鼓励医疗器械创新发展,完善相关技术要求,加大对违法行为处罚力度等方面,对医疗器械注册备案管理制度进行了完善和细化。
3.国家医保局发布《关于印发药品和医用耗材集中采购公共服务事项清单的通知》,通知要求,各省级集采机构要在省级医保局领导下,根据清单制定办事指南,内容包含事项名称、受理单位、服务对象、办理渠道、申请条件、申请材料、办理程序、办理时限、评价渠道等,同步规范线上和线下办理事项及办事流程。
4.国家药监局发布《应用纳米材料的医疗器械安全性和有效性评价指导原则第一部分:体系框架》。指导原则包括适用范围、一般原则、理化表征、生物学评价、动物实验、体外替代测试/计算机模拟研究、临床评价、术语与定义等内容。在充分吸收最新科研成果的基础上,为应用纳米材料的医疗器械安全性和有效性评价提供可行的工具、手段和标准。
5.国家药监局决定对注射用磷酸肌酸钠说明书的内容进行统一修订完善,对其【成份】【适应症】【用法用量】【不良反应】【禁忌】【注意事项】【儿童和老年人用药】等项都做了明确的阐述。
6.国际标准《医用电气设备 第2-90部分:高流量呼吸治疗设备的基本安全和基本性能专用要求》,由国际标准化组织(International Organization for Standardization,ISO)和国际电工委员会(International Electrotechnical Commission,IEC)官网发布(标准号:ISO 80601-2-90:2021),这是由我国提出并负责完成的首个新冠肺炎疫情防控医疗器械国际标准项目。
7.国家药监局药审中心(CDE)发布《纳米药物质量控制研究技术指导原则(试行)》《纳米药物非临床药代动力学研究技术指导原则(试行)》《纳米药物非临床安全性研究技术指导原则(试行)》,以规范和指导纳米药物研究与评价。三个指导原则自发布之日起施行。
8.CDE发布《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》,按古代经典名方目录管理的中药复方制剂属于中药注册分类3.1类。该指导原则围绕中药3.1类的特点明确药学研究的基本原则和相关要求,自发布之日起施行。
9.CDE就《境外生产药品上市后备案类变更办理程序和要求(征求意见稿)》公开征求意见。按照《征求意见稿》内容,境外生产药品上市后备案类变更的审查时限为60个工作日,经审查对备案内容有异议的,将修改国家药监局网站“境外生产药品备案信息公示”的公示信息。
10.CDE就《中药新药毒理研究用样品研究技术指导原则(征求意见稿)》《药物非临床依赖性研究技术指导原则(征求意见稿)》《创新药临床药理学研究技术指导原则(征求意见稿)》《E18:基因组采样和基因组数据管理指导原则》《M3(R2)及问答(R2):支持药物进行临床试验和上市的非临床安全性研究指导原则及问答》公开征求意见。征求意见截止日期均为2021年9月30日;就《利拉鲁肽用于体重管理的临床试验设计指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年10月1日。
11.国家药监局器审中心就《高强韧性纯钛骨科内固定植入物注册审查指导原则(征求意见稿)》《人工韧带注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年10月8日;就《一次性使用高压造影注射器及附件产品注册审查指导原则(征求意见稿)》公开征求意见,征求意见截止日期为2021年9月22日。
产品研发/上市信息
1.国家药监局批准了石家庄以岭药业股份有限公司的中药新药益肾养心安神片上市。本品是在临床经验方基础上研制的中药新药复方制剂,开展了随机、双盲、安慰剂平行对照、多中心临床试验,结果显示可用于失眠症中医辨证属心血亏虚、肾精不足证的治疗。
2.国家药监局批准了上海微创心通医疗科技有限公司生产的创新产品“经导管主动脉瓣膜及可回收输送系统”注册。该产品由瓣膜、输送系统、装载工具和导丝组成。其中瓣膜由三片瓣叶(牛心包)、裙边(PET)、夹片(镍钛)与自膨胀支架(镍钛)通过缝合线(PTFE)缝合而成。
3.国家药监局批准了深圳英美达医疗技术有限公司生产的创新产品“内窥镜用超声诊断设备”的注册申请。该产品为首个国产内窥镜超声诊断设备,产品采用自主开发的高频超声硬件、微型成像探头以及高性能软件构架和图像处理新技术,可以极大地提升内窥镜下超声影像质量,有助于发现早期消化道肿瘤,提高患者的生存率。
4.国家药监局发布3期药品批准证明文件待领信息,共包括149个受理号,涉及辉瑞制药有限公司等企业。(截至9月2日)

5.国家药监局发布3期医疗器械批准证明文件(准产)待领信息,共包括44个受理号,涉及天津正天医疗器械有限公司等企业。(截至9月2日)
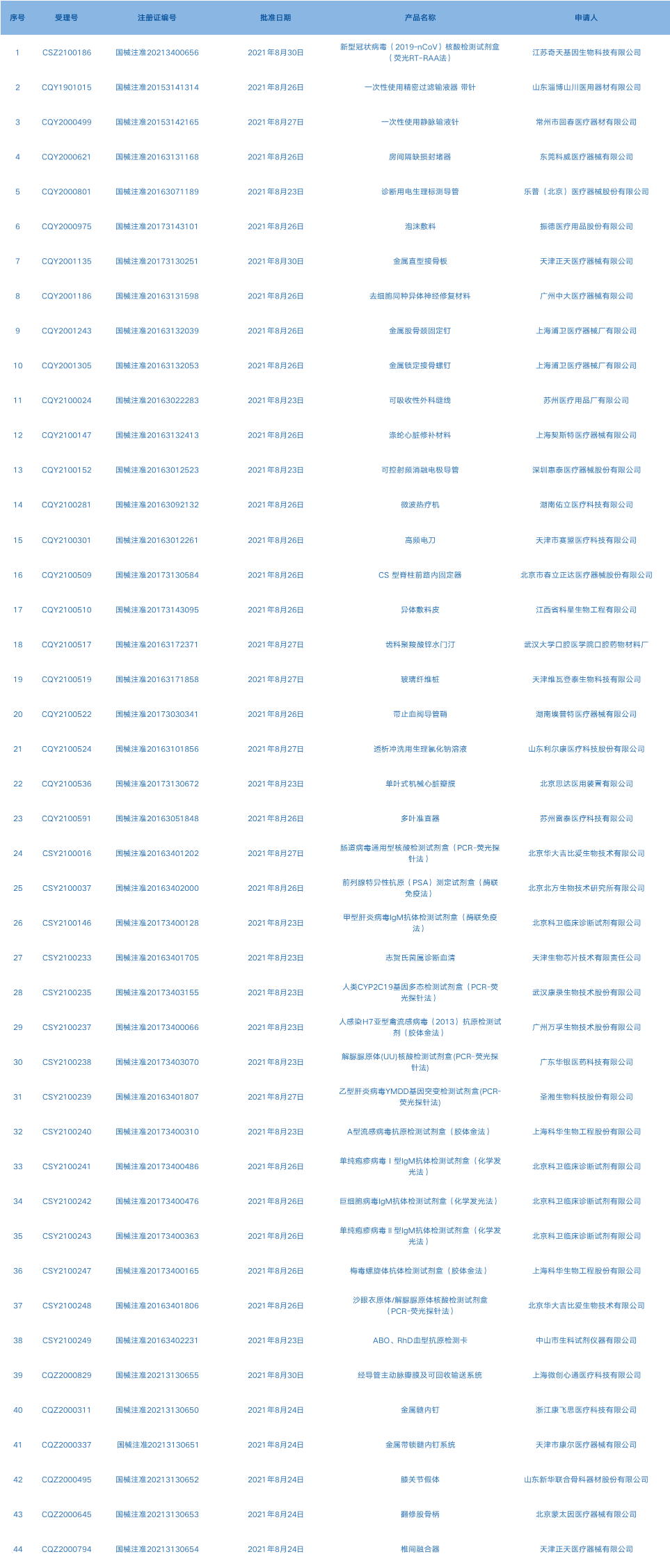
6.CDE网站公示23个仿制药一致性评价任务,涉及雷贝拉唑钠肠溶片等药品。(截至9月2日)
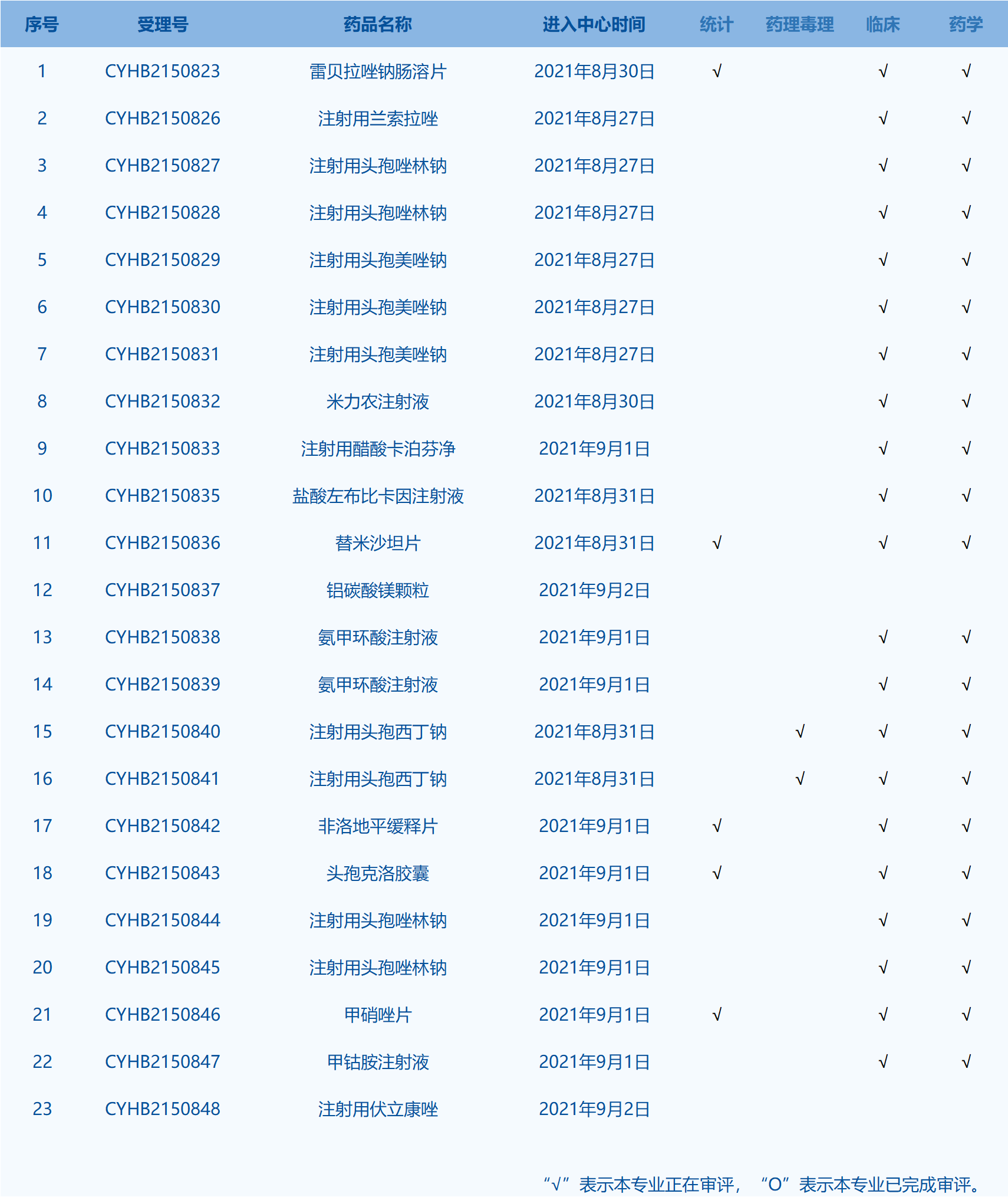
7.CDE承办受理45个新药上市申请,包括AB-106胶囊等药品。(截至9月2日)
8.国家药监局器审中心公示创新医疗器械特别审查申请审查结果,紫杉醇药物涂层外周球囊导管、经导管二尖瓣夹及可操控导引导管、黄斑外加压带、血管斑块旋切系统拟进入特别审查程序。
9.国家药监局器审中心公示医疗器械优先审批申请审核结果,Shockwave Medical,Inc.申请的冠脉血管内冲击波导管符合优先审批情形,拟定予以优先审批。
医药企业观察
1.信达生物宣布与劲方医药达成授权协议,获得后者KRAS G12C抑制剂GFH925在中国的全球独家开发和商业化权利,并拥有全球开发和商业化权益的选择权。信达生物将支付劲方医药2200万美元首付款和累计不超过5000万美元的全球开发支持费用。如果信达生物行使全球权益的选择权,劲方医药还将获得总额不超过2.4亿美元的全球开发、注册及销售里程金,以及基于中国及全球市场内GFH925的年度销售额的梯度特许权使用费。
2.百奥泰生物和Hikma Pharmaceuticals联合宣布,双方就乌司奴单抗生物类似药(代号:BAT2206)签署了在美国市场的独家商业化及授权协议。其中,Hikma公司将获得 BAT2206在美国市场的独家商业化权益。百奥泰可获得2000万美元的首付款,以及最高达1.3亿美元的开发和商业化里程碑付款。
3.亿帆医药子公司亿一生物与正大天晴药业集团南京顺欣制药有限公司签订合作协议,亿一生物将长效粒细胞集落刺激因子(G-CSF)F-627的中国商业化权益独家授权给正大天晴南京顺欣,并将获得最高可达2.1亿元的首付款与里程碑付款,及分级的净销售额提成费。
4.加科思药业宣布战略投资一家名为Hebecell的生物科技公司,并将与其在全球共同开发新一代基于诱导性多能干细胞的自然杀伤细胞疗法(iPSC-NK)。
5.奕拓医药宣布完成B轮融资。本轮融资由高瓴创投和阿斯利康中金医疗产业基金共同领投,晨兴创投跟投。现有股东杏泽资本、泰福资本和诺恺资产继续追加投资。本轮融资资金将用于加速蛋白液-液相分离技术平台的建设,持续推进临床研究和后续管线的开发。
6.凌科药业宣布完成5000万美元的B轮融资。本轮融资由礼来亚洲基金领投,联新资本、杭州和达生物医药产业基金跟投。本轮融资资金将主要用于推进凌科药业研发管线中多个项目临床1、2期试验,拓展国际业务合作和支持新项目的临床前开发。
7.达石药业宣布近日完成近亿元人民币的A轮融资。本轮融资由凯泰资本领投,Pre-A轮投资方深圳分享投资和中山香商投资继续参与本轮融资。本轮融资获得的资金将主要用于推进该公司首个无成瘾长效镇痛药物DS002的1期及2a期临床研发,另外也用于丰富公司的研发管线、建设CMC中试平台、扩充人才团队及其它公司运营需求。
8.辉诺医药宣布完成1亿元人民币A+轮融资。本轮融资由博儒资本领投,博瑞医药、朗煜资本等跟投,现有投资方元禾原点等继续持股。本轮融资资金将主要用于快速推进公司多款核心产品的临床开发,拓展产品管线及推动公司早期项目研发。
药械集中采购
1.上海市药事所发布关于执行第五批国家组织药品集中采购中选结果的工作提示,第五批国家组织药品集中采购产生的ω-3鱼油中/长链脂肪乳注射液等61个药品中选结果,预计将于10月下旬在上海市正式执行。
2.山西省药械集中招标采购中心发布《关于开展规范平台化学药品挂网采购工作的通知》,明确化药挂网采购思路,形成直接挂网和备选药品挂网两种目录,以同组挂网产品参考价经差比计算后的最低价做为基准价,不高于1.8倍基准价可入围直接挂网目录,超过的企业可重新报价入围,限价不高于1.8倍基准价。
3.河南省医保局印发《河南省公立医疗机构药品和医用耗材联盟采购试点方案》,成立由135家省内三级公立医疗机构(含军队医疗机构)共同组成的医疗机构药品和医用耗材采购联盟。除国家和省级集中采购的产品外,技术成熟、临床必需、价值较高的品种,以及其他适合联盟采购的品种均可纳入集采范围。采购联盟可通过联合议价、谈判、竞价等多种方式开展采购工作。
4.河南省医保局发布通知,就第五批国家组织药品集中采购和重庆药品采购联盟保供稳价带量采购中选结果落地实施相关工作进行部署。相关中选品种将从2021年10月1日起执行;其中,注射用盐酸吉西他滨、注射用兰索拉唑、盐酸帕洛诺司琼注射液(1.5ml:0.075mg;5ml:0.25mg)、中/长链脂肪乳注射液(C8-24 Ve)四个产品继续执行省集采结果,省集采采购协议期满后自2022年3月1日起执行国采结果。
5.黑龙江省药品集中采购网发布通知,自2021年8月24日废止以下两个文件:《关于东北三省开展公立医疗机构药品采购“两票制”工作有关事项的通知》和《关于“东北三省一区”公立医疗机构药品采购“两票制”界定结果的补充通知》。该文件由吉林、辽宁、黑龙江、内蒙古卫健委联合发出,也就是三省一区同步执行。
6.青海省发布《关于推动药品集中带量采购工作常态化制度化开展实施方案》,明确实行全省统一部署、统一推进、统一实施,推动药品集中带量采购工作常态化制度化开展。该实施方案自2021年9月18日起施行。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐