数据 | 2021年8月中美欧批准上市的新药
- 2021-09-07 13:37
- 作者:陈倩
- 来源:中国食品药品网
2021年8月,美国、欧盟和中国共有14款新药获批上市,除肿瘤适应症外,还有不少其他治疗领域的突破性疗法。
美国
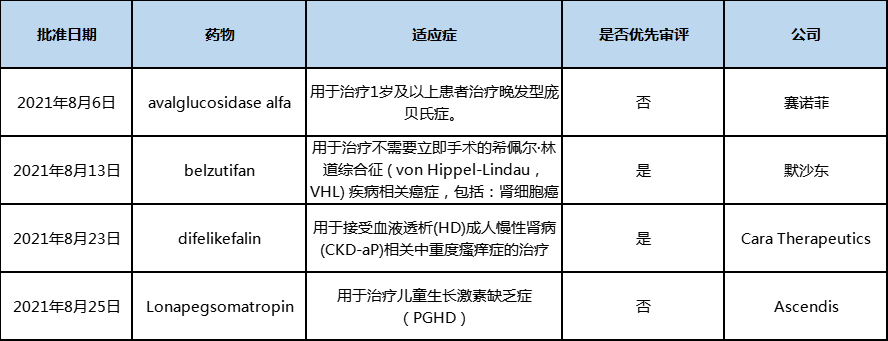
2021年8月美国批准4款新药上市,根据Pharmadigger数据库,均为全球首次批准。
表1 2021年8月美国批准上市的新药
Avalglucosidase alfa可以帮助减少糖原积累,每2周静脉输注1次。将GAA酶运输到细胞内溶酶体的关键途径是通过M6P受体实现的。该药是一种高效酶替代疗法,可以靶向6-磷酸甘露糖(M6P)受体,来改善细胞酶摄取、提高靶组织中的糖原清除率。获批基于一项随机、双盲、多国、多中心试验(代号为COMET),在100名未接受过治疗的晚发型庞贝病(LOPD)患者中比较了avalglucosidase alfa与阿糖苷酶alfa的疗效和安全性。患者在49周内以1:1的比例随机接受每两周一次静脉注射20mg/kg avalglucosidase alfa或阿糖苷酶α。试验的主要终点(从基线到第49周的直立位 FVC(预测百分比)的变化)和次要终点(从基线到第49周的6分钟步行总距离(6分钟步行测试,6MWT)的变化)均表现出avalglucosidase alfa优于阿糖苷酶alfa的临床疗效。该药此前被FDA授予治疗庞贝病突破性疗法资格和快速通道资格。
Belzutifan是FDA批准的首个HIF-2α抑制剂疗法。通过抑制HIF-2α,belzutifan可降低与细胞增殖、血管生成和肿瘤生长相关的HIF-2α靶基因的转录和表达。Belzutifan的获批基于一项正在进行中的Ⅱ期开放性临床试验Study 004,该试验入组了61名VHL种系变异的RCC患者,同时试验也对其他服用belzutifan的VHL相关肿瘤患者的疗效进行了评估,包括CNS血管细胞瘤和pENTs。结果显示了belzutifan在VHL相关癌症中的治疗效力,其中VHL-RCC患者的ORR达到了49% (95% CI:36, 62,所有服用belzutifan获得响应的患者从接受治疗开始起至少被监测18个月),但DOR未达试验终点。该药此前被FDA授予突破性疗法资格。
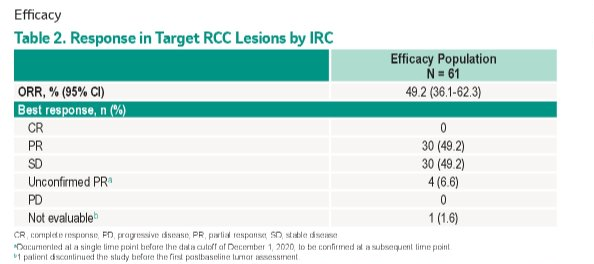
图1 Belzutifan根据独立影像评估委员会评价的RCC疾病应答率
Difelikefalin是一款first in class高选择性k阿片受体(KOR)完全激动剂,能够抑制产生瘙痒的外周神经元的活性,并且对其他受体(包括mu或delta阿片类受体)、离子通道或转运体无显著活性。另外,不同于小分子KOR激动剂,difelikefalin是一款小型合成肽,主要激活外周神经元(PNS)和免疫细胞表达的KORs。批准基于两项关键Ⅲ期临床试验,包括在美国开展的KALM-1试验和全球性KALM-2试验,以及来自额外32项临床研究的支持性数据。在KALM-1试验中,伴有中度至重度CKD-aP的血液透析患者,接受difelikefalin注射液治疗后,瘙痒的WI-NRS评分和生活质量指标相对于安慰剂组都表现出统计学意义的显著改善。
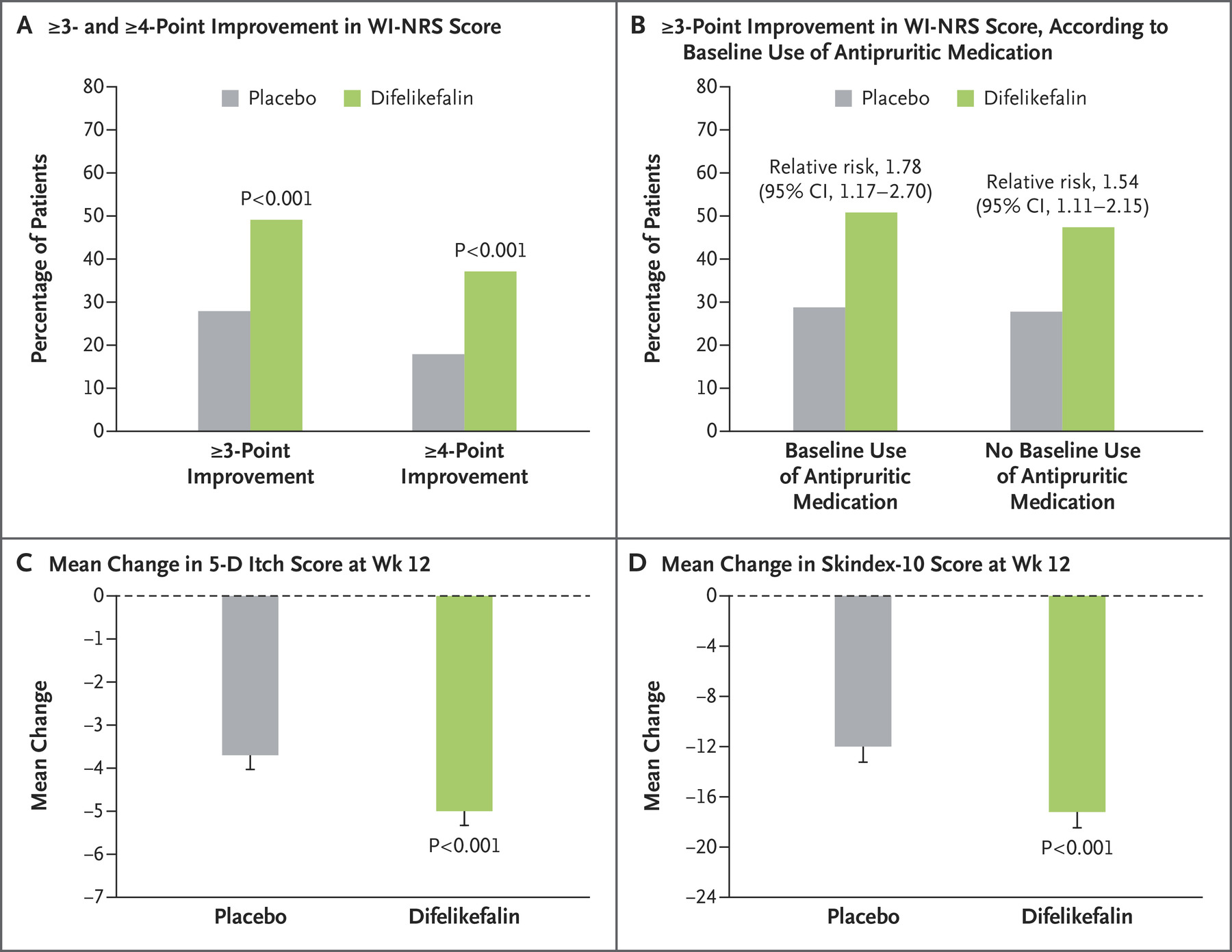
图2 KALM-1试验有效性结果
Lonapegsomatropin是美国FDA批准的首个通过一次注射,可于一周内持续释放,递送生长激素的产品。Lonapegsomatropin的安全性和有效性在Ⅲ期临床试验中得到支持。161名无治疗史生长激素缺乏症患儿参与此次研究,比较每周一次的lonapegsomatropin与每日生长激素genotropin。研究结果显示,在第52周时,两者生长速度的治疗差异为0.9cm/year ,其中lonapegsomatropin组为11.2cm/year,genotropin组为10.3cm/year。此外,lonapegsomatropin达到了生长速度主要终点,并且与每日生长激素genotropin相比,lonapegsomatropin在治疗生长激素缺乏症患儿时有更高的生长速度,且安全性相似。

图3 Lonapegsomatropin的Ⅲ期临床试验有效性结果
欧盟
2021年8月份欧盟批准了5个新药上市,其中bimekizumab、bimekizumab 和vosoritide是首次在全球获批上市,其余均在美国或其他国家首先获批。
表2 2021年8月欧盟批准上市的新药
罗沙司他是一种可口服的强效可逆性低氧诱导因子脯氨酰羟化酶抑制剂( HIF-PHI),能够短暂稳定并激活HIF转录因子,启动适应性转录反应,从而在含氧量正常的条件下,模拟在人体低氧环境下才发生的促红细胞生成反应,包括产生内源性促红细胞生成素以及通过减少铁调素进行铁动员,最终诱导红细胞生成,改善贫血。此前,FDA曾拒绝罗沙司他的新药上市申请,并要求申请者在重新提交新药申请之前,必须对罗沙司他进行额外的安全性临床研究。
Bimekizumab是一种具有双重作用IL-17A/IL-17F抑制剂,是欧盟第一个批准的旨在同时选择性抑制IL-17A和IL-17F的斑块型银屑病治疗药物。批准基于多项全球多中心Ⅲ期临床试验,分别为BE VIVID、BE READY、BE SURE。这几项临床试验均达到主要临床终点及次要临床终点。在BE VIVID试验中,在治疗第16周,与安慰剂组和adalimumab治疗组相比,bimekizumab治疗组同时达到PASI 90缓解(银屑病面积严重程度指数PASI评分改善至少90%)和IGA 0/1缓解的患者比例更高。
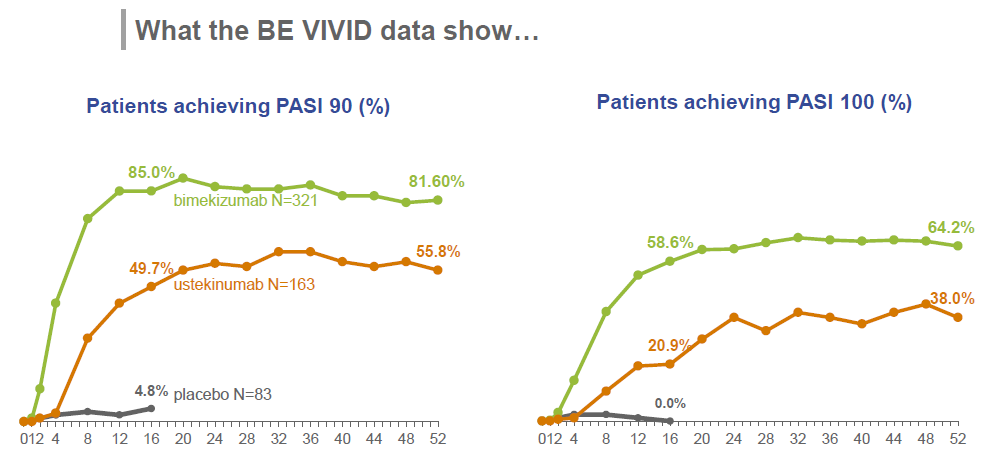
图4 BE VIVID试验结果
Vosoritide是一种有效的软骨内骨化刺激剂(基因靶向药物),天然人肽是骨骼生长的正向调节因子,vosoritide与特定受体结合,启动抑制过度活跃的FGFR3通路的细胞内信号。此次批准是基于Ⅲ期临床试验,共招募了121名5-18岁软骨发育不全儿童,随机分组接受vosoritide或安慰剂,每天注射1次,治疗为期52周。结果显示,接受vosoritide的儿童相较于安慰剂组平均每年多长高1.57cm,这意味着他们的生长速度基本赶上了同龄人。此外,美国FDA正在审评vosoritide的新药申请(NDA)。
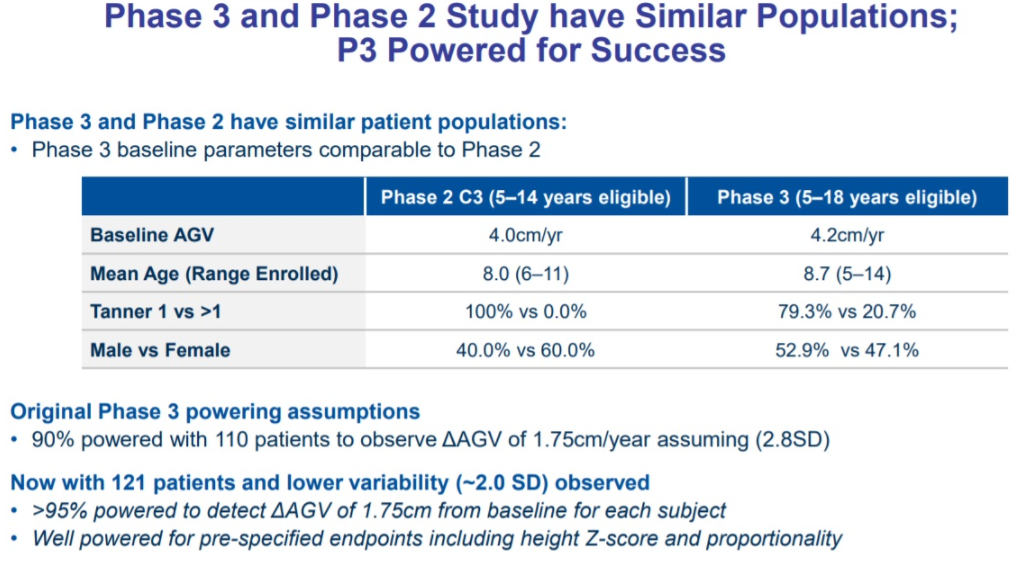
图5 Vosoritide Ⅲ期临床试验设计及有效性结果
Tafasitamab是一种人源化fc修饰的靶向CD19的细胞溶解单克隆抗体,2020年7月在美国首次获批上市,与来那度胺联合使用,用于治疗复发或难治性DLL患者,包括低级别淋巴瘤引起的DLL,以及不符合自体干细胞移植(ASCT)条件的成年患者。本次批准基于开放标签、单臂、二期研究,在81名患者中,80名接受了tafasitamab+来那度胺治疗并纳入整体分析。截至2020年10月30日,经过≥35个月的随访,17名患者仍在接受tafasitamab单药治疗。结果显示,主要终点最佳客观缓解率(ORR)为57.5%(n=46),完全缓解率(CR)为40%(n=32),部分缓解率(PR)为17.5%(n=14);次要终点反应持续时间中位数(mDOR)为43.9个月。
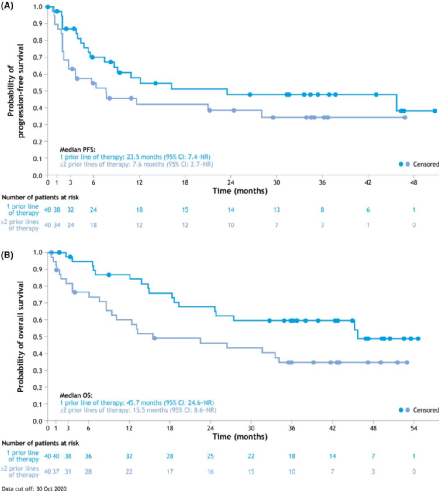
图6 Tafasitamab II期临床试验有效性结果
中国
中国在2021年8月批准了5款新药,其中2款新药为中国药企自主研发的新药,为中国上市的第5、第6个PD-1抗体药物,均批准用于治疗复发难治性经典型霍奇金淋巴瘤(R/R cHL)。其他三个新药均已在美国、日本获批上市。
表3 2021年8月中国批准上市的新药
派安普利单抗在2021年ASCO上公布了AK105-201研究,这是一项纳入了94名R/R cHL患者的I/II期单臂临床试验,使用派安普利单抗(200mg Q2W)治疗。结果显示,派安普利单抗单药治疗的客观缓解率(ORR)高达89.4%,完全缓解率(CR)为47.1%。更令人激动的是,中位随访15.8个月,中位无进展生存期(PFS)仍未达到,12个月无进展生存率达到了72.1%,18个月总生存(OS)率为100%。
AK105-201试验有效性结果
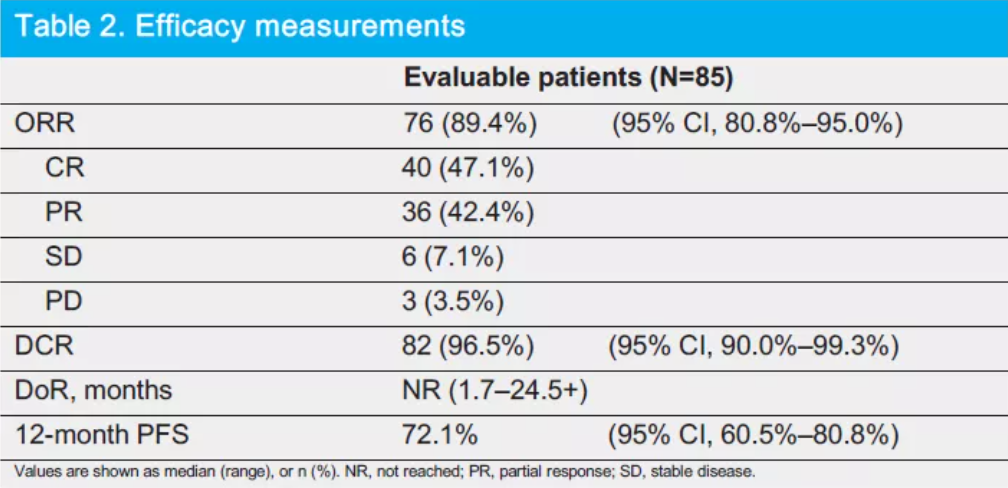
赛帕利单抗在2020年ASCO会议上公布了治疗R/R cHL患者的II期临床试验数据,研究共纳入85例既往接受过二线以上系统化疗的R/R cHL患者。截至2021年4月28日,经研究者评估,客观缓解率(ORR)高达92.86%,疾病控制率(DCR)达到96.43%。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐