GVP逐条谈 | 75.PASS上市后安全性研究
- 2021-09-07 15:47
- 作者:张春惠
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》第五章 风险识别与评估
第三节 药品上市后安全性研究
第七十五条 持有人开展药品上市后安全性研究应当制定书面的研究方案。研究方案应当由具有适当学科背景和实践经验的人员制定,并经药物警戒负责人审核或批准。
研究方案中应当规定研究开展期间疑似药品不良反应信息的收集、评估和报告程序,并在研究报告中进行总结。
研究过程中可根据需要修订或更新研究方案。研究开始后,对研究方案的任何实质性修订(如研究终点和研究人群变更),应当以可追溯和可审查的方式记录在方案中,包括变更原因、变更内容及日期。
【理解】
第七十五条规定了药品上市许可持有人开展上市后安全性研究(post-authorisation safety study,PASS)需要有书面研究方案并产出研究报告,要求研究方案制定人员需具有适当学科背景和实践经验,并由药物警戒负责人审批。药物警戒负责人职责请参照《GVP逐条谈 | 25.药物警戒负责人,PV体系负责人》。
·PASS的研究方法
PASS根据所采用的研究方法不同分为干预型和非干预型研究。
■ 非干预型研究应符合如下要求:
1. 按常规程序获得上市批准的药品;
2. 方案研究设计中对于患者分组采用盲法原则;
3. 不干预临床医疗行为,研究中无需额外诊断或监测程序;
4. 同时使用流行病学方法对收集的数据进行分析。
■ 干预型研究即临床试验型PASS试验方案通常包括基本信息、研究背景资料、试验目的、试验设计、实施方式(方法、内容、步骤)等内容,具体参考《药物临床试验质量管理规范》第六章。
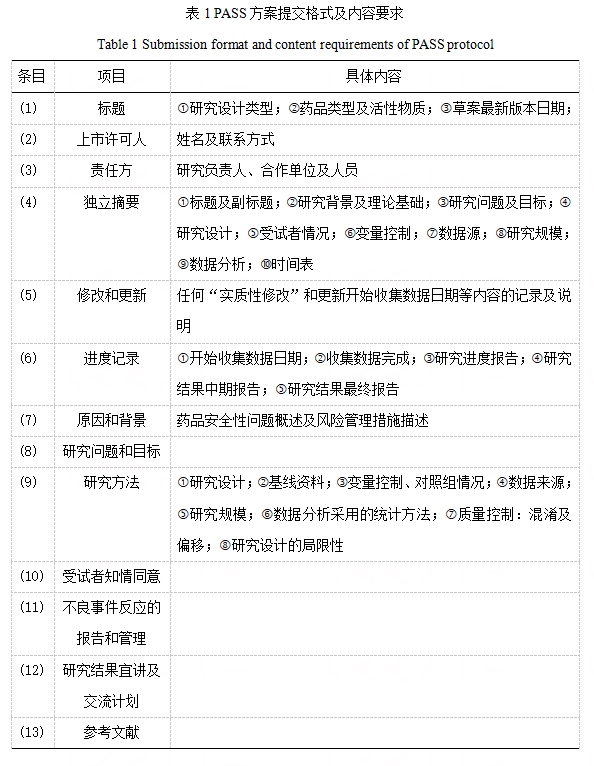
此外还可以参考照欧盟规范卷10《临床试验指南》有关要求严格设计研究方案,提交格式及要求如下:
·疑似药品不良反应信息的收集、评估和报告
研究方案中应当规定研究开展期间疑似药品不良反应信息的收集、评估和报告程序,并在研究报告中进行总结。
疑似药品不良反应信息的收集可参照:GVP第四章第一节 信息的收集;
对收集到的信息评估可参照:GVP第四章第二节 报告的评价与处置;
报告要求可参照:GVP第四章第二节 报告的提交。
·PASS研究结果报告
PASS研究结果报告要求可参照:《药物临床试验质量管理规范》第二十五条、第二十六条,格式要求与研究方案基本一致,但需增加部分额外研究内容。
具体包括:
l .统计分析
在PASS研究方案条目9“研究方法”项目以外,需增加以下内容:研究所采用的所有统计学方法;两组结果比较采用的分析方法;ƒ脱落病例的数据分析;敏感性分析;统计方法变更记录及说明。
2 .结果分析
每个研究阶段受试者数量;描述性分析受试者基线资料;脱落病例;ƒ结果数据;主要结果分析;其他分析;不良事件/不良反应。
3 .增加讨论
分析影响效益风险评估的关键结果;研究方法及统计方法的局限性;ƒ根据研究目标解释最终研究结果;普适性问题。
·确保源数据可溯源
研究开始后,对研究方案的任何实质性修订均应当以可追溯和可审查的方式记录在方案中,即每个方案需要有版本、内容和追溯,保障源数据可以溯源。
【实践影响】
研究方案是一项研究的灵魂,MAH应重视研究方案的制定。
【延伸阅读】
《药物临床试验质量管理规范》
欧盟《药物警戒质量管理规范》
EudraLex-Volume10-Clinical trials guidelines
(浙江太美医疗科技股份有限公司医学专员 张春惠)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

行政处罚裁量 | 不确定法律概念有了确定的范围——浅析《药品监督管理行政处罚裁量适用规则》
《裁量规则》对“初次违法”“危害后果轻微”“及时改正”“充分证据”“情节严重”等不确定法律概念进行了不同程度的细化、明确、缩窄范围,并对适用这些不确定法律概念需要注意的事项给予规范... 2024-04-23 14:07 -