每周医药看点(1.5-1.11)
- 2022-01-12 16:31
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 《已上市中药说明书安全信息项内容修订技术指导原则(试行)》《国家药品监督管理局重点实验室考核评估规则(试行)》等文件发布;国家药监局发布第五十批仿制药参比制剂目录;创新药淫羊藿素软胶囊通过优先审评审批程序附条件批准上市……1月5日-11日,医药行业的这些事情值得关注。
行业政策动态
1.国家药监局发布《已上市中药说明书安全信息项内容修订技术指导原则(试行)》,《指导原则》明确坚持中医药理论指导、全生命周期管理和表述科学、规范、准确的基本原则,列出修订的基本思路和要求,其内容科学性高、“中药味”浓、实操性强,部分已上市中药说明书警示语、不良反应、禁忌、注意事项、特殊人群用药等安全信息项有望加速告别“尚不明确”。
2.国家药监局印发《国家药品监督管理局重点实验室考核评估规则(试行)》,明确考核评估工作包括考核和评估,考核每年开展一次,评估每5年开展一次。所有通过国家药监局评审认定的重点实验室均应当参加考核和评估。评估结果为优秀的重点实验室将获得通报表扬等,评估结果为不合格的或被取消重点实验室资格。
3.国家药监局发布仿制药参比制剂目录(第五十批),涉及阿法骨化醇滴剂等药品。
4.国家药监局综合司就《药品生产质量管理规范-细胞治疗产品附录(征求意见稿)》公开征求意见,征求意见稿共11章53条,所述的细胞治疗产品(以下简称细胞产品)是指人源的活细胞产品,包括经过或未经过基因修饰的细胞,如自体或异体的免疫细胞、干细胞、组织细胞或细胞系等产品,不包括输血用的血液成分、已有规定的移植用造血干细胞、生殖相关细胞,以及由细胞组成的组织、器官类产品等。征求意见截止日期为2022年2月7日。
5.国家药监局药审中心(CDE)发布《中药新药毒理研究用样品研究技术指导原则(试行)》《抗狂犬病病毒单克隆抗体新药临床试验技术指导原则》《药物临床试验随机分配指导原则(试行)》《创新药人体生物利用度和生物等效性研究技术指导原则》《改良型新药调释制剂临床药代动力学研究技术指导原则》《罕见疾病药物临床研发技术指导原则》《预防抗肿瘤药物所致恶心呕吐药物临床试验设计指导原则(试行)》《肾功能不全患者药代动力学研究技术指导原则(试行)》《“临床风险管理计划”撰写指导原则(试行)》《慢性丙型病毒性肝炎直接抗病毒药物临床试验技术指导原则》《溃疡性结肠炎治疗药物临床试验技术指导原则》《克罗恩病治疗药物临床试验技术指导原则》《新药研发过程中食物影响研究技术指导原则》《药物非临床依赖性研究技术指导原则》。
6.CDE发布《药物临床试验期间个例安全性报告适用E2B(R3)区域实施指南》的通知。CDE已完成对临床试验期间药物警戒系统升级改造,已于2022年1月1日上线试运行。申请人应及时完成系统配置,并按照区域实施指南要求实施E2B(R3),时间不得晚于2022年7月1日。
7.CDE就《基于“三结合”注册审评证据体系下的沟通交流技术指导原则(征求意见稿)》公开征求意见,以推动构建中医药理论、人用经验和临床试验相结合的中药注册审评证据体系,指导在“三结合”审评证据体系下研发的中药新药提出临床专业沟通交流申请。
产品研发/上市信息
1.国家药监局通过优先审评审批程序附条件批准1.2类创新药淫羊藿素软胶囊上市。该药用于不适合或患者拒绝接受标准治疗,且既往未接受过全身系统性治疗的、不可切除的肝细胞癌,患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400 ng/mL;TNF-α<2.5 pg/mL;IFN-γ≥7.0 pg/mL。该品种药品上市许可持有人为北京珅诺基医药科技有限公司。
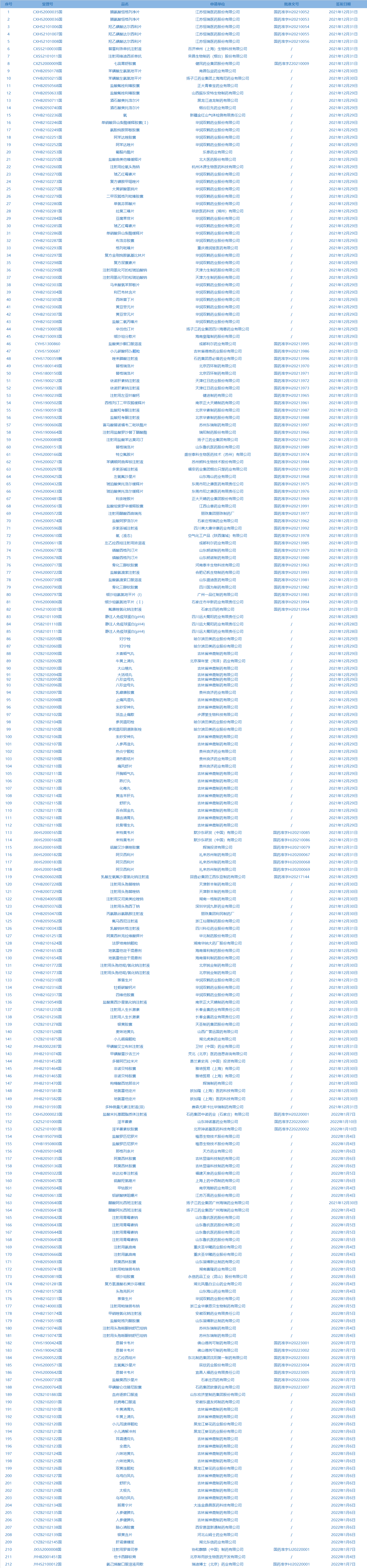
2.国家药监局发布3期药品批准证明文件待领信息,共包括212个受理号,涉及江苏恒瑞医药股份有限公司等企业。(截至1月11日)
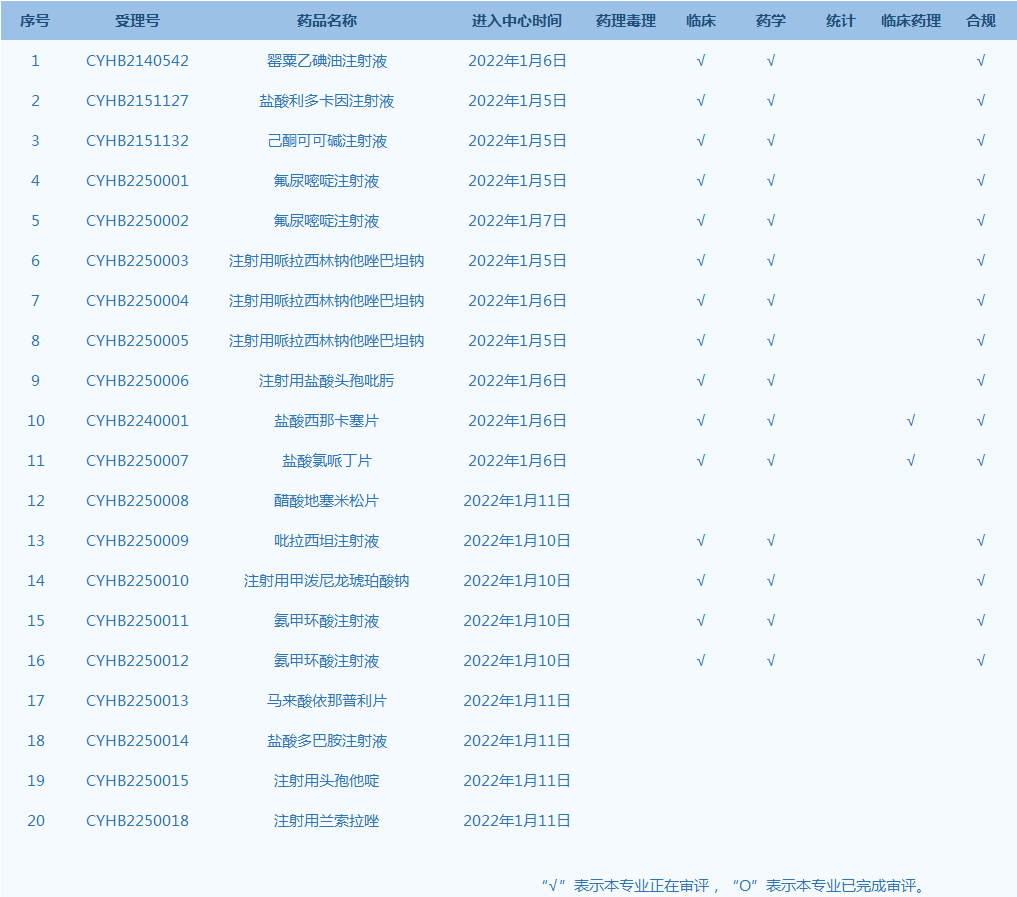
3.CDE网站公示20个仿制药一致性评价任务,涉及罂粟乙碘油注射液等药品。(截至1月11日)
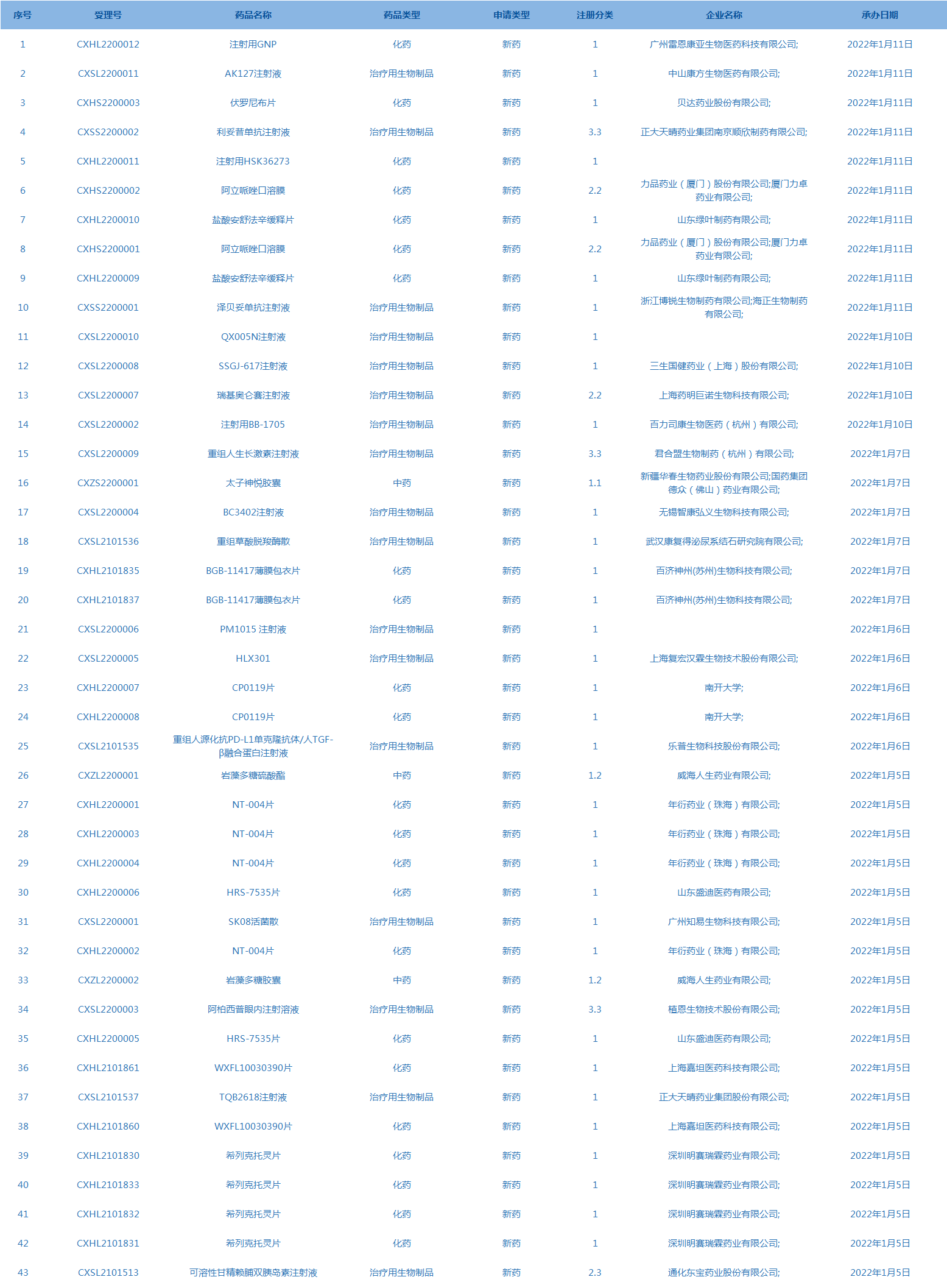
4.CDE承办受理43个新药上市申请,包括注射用GNP等药品。(截至1月11日)
医药企业观察
1.华大基因发布公告称,其全资子公司BGI Europe A/S的肠癌辅助诊断产品获得沙特阿拉伯食品药品管理局(SFDA)批准上市。
2.艾德生物发布公告称,其基于PCR技术平台自主研发的肺癌多基因联合检测产品“AmoyDx® Pan lung cancer PCR panel”(即PCR-11基因)被纳入日本医保。
3.科济药业宣布,其自主研发的CAR-T产品CT041被美国FDA授予再生医学先进疗法(RMAT)资格,用于治疗Claudin18.2(CLDN18.2)阳性的晚期胃癌/食管胃结合部腺癌(GC/GEJ)。
4.华海药业发布公告称,公司产品琥珀酸美托洛尔缓释片、赛洛多辛胶囊、氨酚氢可酮片通过美国FDA新药简略申请(ANDA)。
5.红日药业发布公告称,其在研产品注射用甲磺酸苦柯胺B获得美国FDA授予快速通道资格,用于治疗脓毒症。
6.康恩贝发布公告,宣布与康臣药业签署战略合作框架协议,根据公告双方将围绕股权、营销、研发、资产和业务等方面展开合作。
7.君实生物与阿斯利康签署《独家推广协议之终止协议》,从2022年1月1日起,原协议终止,公司收回原协议约定的特瑞普利单抗注射液推广权。
8.亚虹医药于2022年1月7日在上交所科创板正式上市。亚虹医药是一家即将进入商业化阶段、专注于泌尿生殖系统肿瘤及其它重大疾病领域的全球化创新药公司。
药品集中采购
1.国家组织药品联合采购办公室发布《关于公布全国药品集中采购(胰岛素专项)首年协议采购量的通知》,通知指出,各医药机构已根据《全国药品集中采购文件(胰岛素专项)(GY-YD2021-3)》规定,完成胰岛素专项中选产品协议采购量的确认工作,国家组织药品集中采购(胰岛素专项)全国首年协议采购量和各地区首年协议采购量已经确定。本次胰岛素专项集采中选结果将于2022年5月实施,具体执行日期以各地发布通知为准。
2.广东省医保局发布《关于进一步做好国家医保谈判药品落地工作的通知》,明确《广东省基本医疗保险、工伤保险和生育保险药品目录(2022年版)》自2022年1月1日起正式执行,198家医院纳入国谈药品定点医疗机构名单。
3.内蒙古自治区医保局印发《内蒙古自治区“双通道”管理药品目录》,共涉及176个药品,同时明确“双通道”管理药品目录将实行动态管理。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐