浅谈化妆品留样相关法规要求
- 2022-04-01 17:01
- 作者:贺龙强
- 来源:中国食品药品网
问:化妆品注册人、备案人应当如何对产品留样?留样的数量如何确定?
答:依据《化妆品生产经营监督管理办法》《化妆品注册备案资料管理规定》《化妆品生产质量管理规范》,化妆品注册人、备案人应当对每批次出厂的产品留样。该留样制度的目的是为保证产品质量安全可追溯,压实化妆品注册人、备案人对产品质量安全的主体责任;同时在已销售的产品出现质量安全问题以及被假冒等情形时,便于查验每批次产品的合法性和安全性。
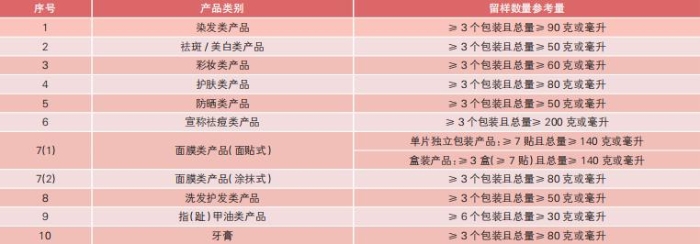
在留样制度的实际执行中,根据上述法规规定,同时为节约企业经营成本,综合考虑不同的产品类别、包装规格、成品状态等因素,国家药监局化妆品监管司参考监管工作实际并结合行业调研情况,梳理了市场上销售的常见产品的留样数量(见表),供广大企业在生产经营实践中参考。对于表中未列的产品类型,请化妆品注册人、备案人按照法规要求自行确定留样数量。
问:进口化妆品注册人、备案人对其进口中国的化妆品应在哪里留样?
答:2021年11月,国家药监局《关于贯彻执行〈化妆品生产经营监督管理办法〉有关事项的公告》明确,2022年1月1日后境外化妆品注册人、备案人应当对其进口中国的每批次产品进行留样,样品及记录交由境内责任人保存。分多次进口同一生产批次产品的,应当至少于首次进口时留样一次。
依据《化妆品生产质量管理规范》,委托生产的化妆品注册人、备案人应当在其住所或者主要经营场所留样,也可以在其住所或者主要经营场所所在地的其他经营场所留样。对“其住所或者主要经营场所所在地”中“所在地”的理解,通常认定为不超出同一地级市或者同一直辖市的行政区域内。境内责任人保存留样的,其留样地点的选择应当参照上述规定执行。留样地点的选择,应当能够满足法律法规的规定和标签标示的产品贮存要求。
表 化妆品注册人、备案人产品留样数量参考表
注:彩妆类产品净含量低于1g的,在成品留样的同时,可以结合其半成品对产品进行留样,留样应当满足产品质量检验的需求。
——国家药监局《化妆品监督管理常见问题解答(三)》
随着《化妆品监督管理条例》(以下简称《条例》)、《化妆品生产经营监督管理办法》(以下简称《办法》)、《化妆品生产质量管理规范》(以下简称《规范》)等法规文件的陆续出台,化妆品生产监督管理法规体系日趋完善。产品留样作为生产质量管理体系中的重要组成部分,受到行业普遍关注。针对不同化妆品生产企业主体如何落实留样要求,国家药监局在《化妆品监督管理常见问题解答(三)》中进一步予以明确。
压实企业质量安全主体责任
留样要求旨在确保产品可追溯,进一步压实企业主体责任。
《条例》首次提出化妆品注册人、备案人制度,明确化妆品注册人、备案人对化妆品的质量安全和功效宣称负责;《规范》进一步规定,化妆品注册人、备案人、受托生产企业要实现对化妆品物料采购、生产、检验、贮存、销售和召回等全过程的控制和追溯。产品留样是实现全程追溯的重要一环。一方面,企业留样产品是该批次产品的代表,其质量一定程度上代表着该批次产品的整体质量。《规范》明确,留样保存期限不得少于产品使用期限届满后6个月,这可在一定程度上督促企业严格按照《规范》要求合法合规生产。另一方面,当企业发现留样产品在使用期限内变质时,可及时分析原因并依法召回已上市销售的该批次化妆品,主动消除安全风险,此举一定程度上可提高问题产品发现率,减轻因此带来的不利后果。另外,进行留样期内产品稳定性观察,有助于企业完善升级产品配方与工艺,提升产品质量。
同时,按规定留样可以保护企业合法权益。2021年10月22日印发的《国家药监局综合司关于进一步做好国家化妆品监督抽检不合格产品核查处置工作的通知》明确,被调查企业否认抽检不合格产品是其生产或者进口时,应当组织对该企业库存或者留样的其他批次或者同类产品进行抽样检验,并要求企业正式出具情况说明,提供相关佐证材料;同时,要求企业加强对不合格产品的追踪溯源。由此可见,当产品被假冒时,企业可以通过检验同批次留样产品的方式自证清白,保护自身合法权益。
精准施策确保新规落地
留样制度的建立体现落实“放管服”改革要求,在保证留样数量满足产品质量检验的前提下,结合实际,综合考虑不同产品类别、包装规格、成品状态等因素,努力降低企业成本。
一是套盒形式售卖的化妆品,在单品留样的前提下,仅需留存套盒外包装。《规范》第十八条第二款规定,销售包装为套盒形式,该销售包装内含有多个化妆品且全部为最小销售单元的,如果已经对包装内的最小销售单元留样,可以不对该销售包装产品整体留样,但应当留存能够满足质量追溯需求的套盒外包装。套盒的包装行为在一定程度上可以理解为外包装行为,包装过程不接触化妆品内容物,对于化妆品质量安全没有太大风险;且单品已经留样,可以满足产品追溯需要。上述要求可为企业减少留样成本。
二是小规格的彩妆类产品,采用成品和半成品结合方式留样。《规范》第十八条第二款规定,出厂的产品为成品的,留样应当保持原始销售包装。严格来讲,出厂的彩妆类产品均为化妆品成品,应该保持原始销售包装留样,但是眉笔等小包装(含量)销售的彩妆类化妆品,如果需要达到产品质量检验需求量,可能要留存上百件产品,特别是在目前订单式生产普遍的情况下,对化妆品生产企业来说负担较重。在法规允许的框架下,国家药监局参考监管工作实际并结合行业调研情况,明确净含量低于1克的彩妆类产品,在成品留样的同时,可以结合其半成品对产品进行留样,留样应当满足产品质量检验的需求。
三是同一生产批次多次进口的产品,留样一次属合规。在以《条例》为主梁的化妆品“四梁八柱”法规体系中,始终坚持“国内国外”“线上线下”一致的原则。国家药监局《关于贯彻执行〈化妆品生产经营监督管理办法〉有关事项的公告》规定,境外化妆品注册人、备案人应当对其进口中国的每批次产品进行留样,样品及记录交由其境内责任人保存。为确保企业知悉留样要求,减轻企业负担,同时统一基层监管执法尺度,《化妆品监督管理常见问题解答(三)》明确,分多次进口同一生产批次产品的,应当至少于首次进口时留样一次。
四是明确企业住所或主要经营场所“所在地”区域范围。根据《规范》第五十六条,委托生产的化妆品注册人、备案人应当在其住所或者主要经营场所留样;也可以在其住所或者主要经营场所所在地的其他经营场所留样。目前,很多委托生产的化妆品注册人、备案人在市区繁华地段办公,办公租赁费用较高,《规范》综合考虑,在确保达到留样目的的前提下,尽量降低企业成本。对“其住所或者主要经营场所所在地”中“所在地”的理解,通常认定为不超出同一地级市或者同一直辖市的行政区域内。境内责任人保存留样的,其留样地点的选择应当参照上述规定执行。另外,笔者认为,为方便企业管理留样产品,企业不宜跨省份留存样品。
企业应明确相关管理要求
企业应制定留样管理制度,可从明确留样执行时间、理解留样管理要求、把握留样数量等方面入手,确保留样相关要求落实到位。
明确留样执行时间。《办法》规定,化妆品注册人、备案人应当按照规定对出厂的化妆品留样并记录;委托生产化妆品的,受托生产企业也应当按照前款的规定留样并记录。国家药监局《关于贯彻执行〈化妆品生产经营监督管理办法〉有关事项的公告》明确,化妆品注册人、备案人应当对2022年1月1日后生产的每批次产品留样并记录;留样应当保持原始销售包装且数量满足产品质量检验的要求;委托生产化妆品的,受托生产企业也应当按规定留样并记录;境外化妆品注册人、备案人应当对其进口中国的每批次产品进行留样,样品及记录交由其境内责任人保存。也就是说,化妆品注册人、备案人以及受托生产企业应当在《办法》施行之日起开始留样。《规范》则进一步细化了留样时间、数量、地点、留样管理等要求,即自今年7月1日起,留样应符合《规范》的细化要求。
理解留样管理要求。化妆品注册人、备案人以及受托生产企业应当依照相关法律法规的规定和标签标示的要求,建立相关制度并有效贮存留样产品,保存留样记录。
仅从事半成品配置的化妆品注册人、备案人以及受托生产企业也应按规定对产品进行留样。根据《规范》,出厂的产品为半成品的,留样应当密封且能够保证产品质量稳定,并应当至少记录留存包括产品名称、企业名称、规格、贮存条件、使用期限等在内的标签信息,保证可追溯。
把握留样数量。《化妆品注册备案资料管理规定》和《规范》着眼于产品的追溯性,分别从注册备案和生产环节提出了关于留样数量的要求,压实企业主体责任,确保产品质量安全。为使化妆品注册人、备案人清晰了解留样数量要求,《化妆品监督管理常见问题解答(三)》从产品类别、包装规格、成品状态等角度列举了市场上常见产品的建议留样数量,消除行业疑虑。法规对化妆品注册人、备案人、受托生产企业的留样数量提出了明确要求,企业应当依法依规留存满足数量要求的产品,委托生产的以及境外化妆品注册人、备案人可以重点参考上述政策问答建议的留样数量进行留样。
(作者单位:山东省食品药品审评查验中心)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李佳欢)
分享至
右键点击另存二维码!
-
为你推荐