4月份中美欧批准上市新药盘点
- 2022-06-01 15:30
- 作者:陈倩
- 来源:中国食品药品网
4月份,中美欧共批准13款新药上市。其中,我国批准6款、美国批准2款、欧盟批准5款。
我国批准6款新药上市
4月份,我国批准了6款新药上市。其中,替戈拉生片是罗欣药业自主研发的新药,信达生物的佩米替尼片和李氏大药厂的盐酸丙卡巴肼胶囊均为合作引进开发。

佩米替尼片是一种针对FGFR亚型1/2/3的强效选择性口服小分子抑制剂,可通过阻断肿瘤细胞中FGFR介导的信号通路来阻止癌细胞的生长和扩散。本次该药获批是基于两项临床试验,分别为在海外和我国进行的II期单臂临床研究。结果显示,接受佩米替尼治疗的胆管癌受试者的客观缓解率约为37%~50%,不同人种间无差异。2018 年12 月,信达生物与Incyte达成战略合作,获得了Incyte包括佩米替尼在内的3款药物在我国进行临床开发和商业化的权益;而Incyte公司则获得信达生物4000万美元的首付款和后续潜在商业里程碑付款。
阿布昔替尼片是一款每日仅需口服一次的Janus 激酶1(JAK1)抑制剂。目前,国内共有5款JAK抑制剂获批上市,除阿布昔替尼外,还有艾伯维的乌帕替尼、诺华的芦可替尼、礼来的巴瑞替尼和辉瑞的托法替布。
作为首个口服TRK抑制剂,拉罗替尼胶囊是专门用于治疗具有神经营养酪氨酸受体激酶(NTRK)基因融合肿瘤的靶向药物。大量的临床试验数据表明,NTRK基因融合可见于多种实体瘤,包括胰腺癌、甲状腺癌、唾液腺癌、乳腺癌、结直肠癌、肺癌等,在婴儿纤维肉瘤、类似乳腺分泌性癌、乳腺分泌性癌等一些罕见的癌症患者体内,NTRK基因融合的发生率可达90%以上。因此,TRK抑制剂具有广谱抗肿瘤活性。
替戈拉生片是一款钾离子竞争性酸阻滞剂(P-CAB),这类产品可通过阻断H+/K+-ATP酶的钾离子通道,竞争性阻滞钾离子与该酶的结合,长时间停留于胃壁细胞,从而快速抑制胃酸的分泌。临床研究显示,相比其他抑酸药物一般需要1.5小时~4小时才能起效,替戈拉生具有30分钟快速起效、强效持久抑酸、服用方便等特点。
盐酸丙卡巴肼胶囊是一种烷化剂药物。药物进入体内经肝微粒体氧化代谢产生甲基或其他烷基自由基,再与DNA作用使其解聚,从而抑制DNA、RNA以及蛋白质的合成。2018年5月,李氏大药厂与Leadiant公司签署经销协议,获得盐酸丙卡巴肼胶囊在大中华区的独家开发权益。
洛拉替尼片是全球首个第三代ALK抑制剂,专门设计用于抑制最常见可导致对当前药物耐药的肿瘤突变和肿瘤脑转移问题,并且可以透过血脑屏障发挥作用。2021年3月3日,洛拉替尼获美国食品药品管理局(FDA)批准用于一线治疗ALK阳性非小细胞肺癌(NSCLC)。
美国批准2款新药上市
2022年4月,美国批准2款新药上市,均为全球首次批准。

Mycovia制药生产的Oteseconazole(商品名:VIVJOA)是美国FDA批准的首个治疗复发性外阴阴道念珠菌病(RVVC)的药物。该药是一种唑类抗真菌药物,可高度特异性抑制真菌CYP51酶。RVVC又称慢性酵母菌感染,通常定义为患者每年发生3次以上有症状的酵母菌感染急性发作。其主要症状包括阴道瘙痒、灼热、刺激和炎症。美国FDA还曾授予Oteseconazole合格传染病产品认定和快速通道资格。2019年6月,恒瑞医药与Mycovia公司达成合作,获得了Oteseconazole在大中华区的独家权益,将开发和商业化Oteseconazole用于治疗或预防一系列真菌疾病。
Mavacamten(商品名:Camzyos)是一款口服选择性心肌肌球蛋白别构调节剂,能降低心壁压力的生物标志物,减少过度的心脏收缩,并增加舒张顺应性,减少梗阻性肥厚型心肌病(oHCM)造成的心脏难以正常扩张的情况。今年2月7日,国家药监局药品审评中心将Mavacamten纳入拟突破性治疗品种清单。
欧盟批准5款新药上市
4月份,欧盟批准5款新药上市,均非全球首次获批新药。
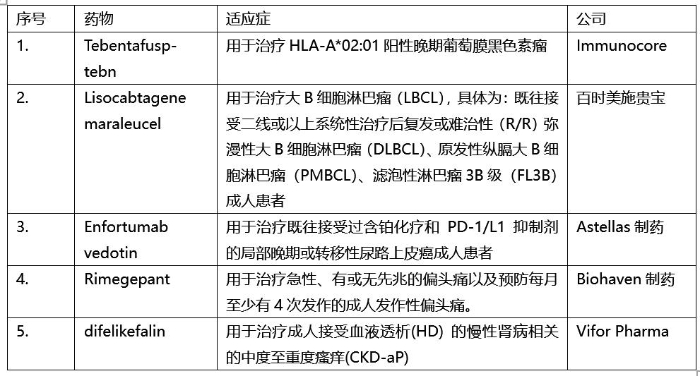
Tebentafusp-tebn(商品名:Kimmtrak)是一种双特异性蛋白,由亲和力增强的T细胞受体与抗CD3效应体融合而成,可将T细胞重定向为靶向gp100阳性细胞。转移性葡萄膜黑色素瘤是一种尚未确定标准治疗的侵袭性疾病,患者的1年总生存率约为50%,目前尚无数据证明患者接受全身性治疗后的总生存获益。在III期临床试验中,患者随机分配接受Kimmtrak治疗或研究者所选治疗方案,结果表明Kimmtrak治疗与对照治疗相比延长了患者的总生存期。
Lisocabtagene maraleucel(商品名:Breyanzi)是靶向CD19抗原的CAR-T细胞疗法,具有明确的组成和4-1BB共刺激域。Breyanzi由纯化的CD8+和CD4+T细胞以特定比例(1:1)组成,4-1BB信号增强了Breyanzi的扩增和持久性,这也是BMS在欧盟获批的第二款CAR-T细胞疗法。该疗法获批基于名为TRANSCEND NHL 001, 二线治疗后复发或难治性大B细胞淋巴瘤(R/R DLBCL、PMBCL、FL3B)患者研究的结果,在216例接受Breyanzi治疗且疗效可评估的患者中,客观缓解率(ORR)为73%、完全缓解率(CR)为53%。
Enfortumab vedotin(商品名:Padcev)由靶向连接蛋白-4(Nectin-4)的人IgG1单克隆抗体Enfortumab与细胞毒制剂MMAE(单甲基奥瑞他汀E,一种微管破坏剂)偶联而成,由 Astellas和Seagen共同开发。此次该药获批得到了全球III期EV-301试验数据的支持,该试验证明Padcev与化疗相比具有总体生存 (OS) 获益优势。
Rimegepant(商品名:Vydura)是一款小分子口服降钙素基因相关肽(CGRP)受体拮抗剂,其口腔崩解片剂可方便服用,是用于治疗和预防急性偏头痛的药物。本次获批基于其III期临床试验结果:与安慰剂相比,服用rimegepant可在两小时内减轻疼痛及改善偏头痛相关症状。
Difelikefalin(商品名:Kapruvia)是一种静脉注射药物,为外周选择性κ阿片受体(KOR)激动剂,通过刺激外周神经和免疫细胞上的κ阿片受体发挥止痒的作用。接受透析治疗的慢性肾脏病(CKD)患者经常伴有瘙痒症状,这种瘙痒症的发病机制目前仍不明确。Difelikefalin最初是于2021年08月23日经美国FDA批准上市。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













