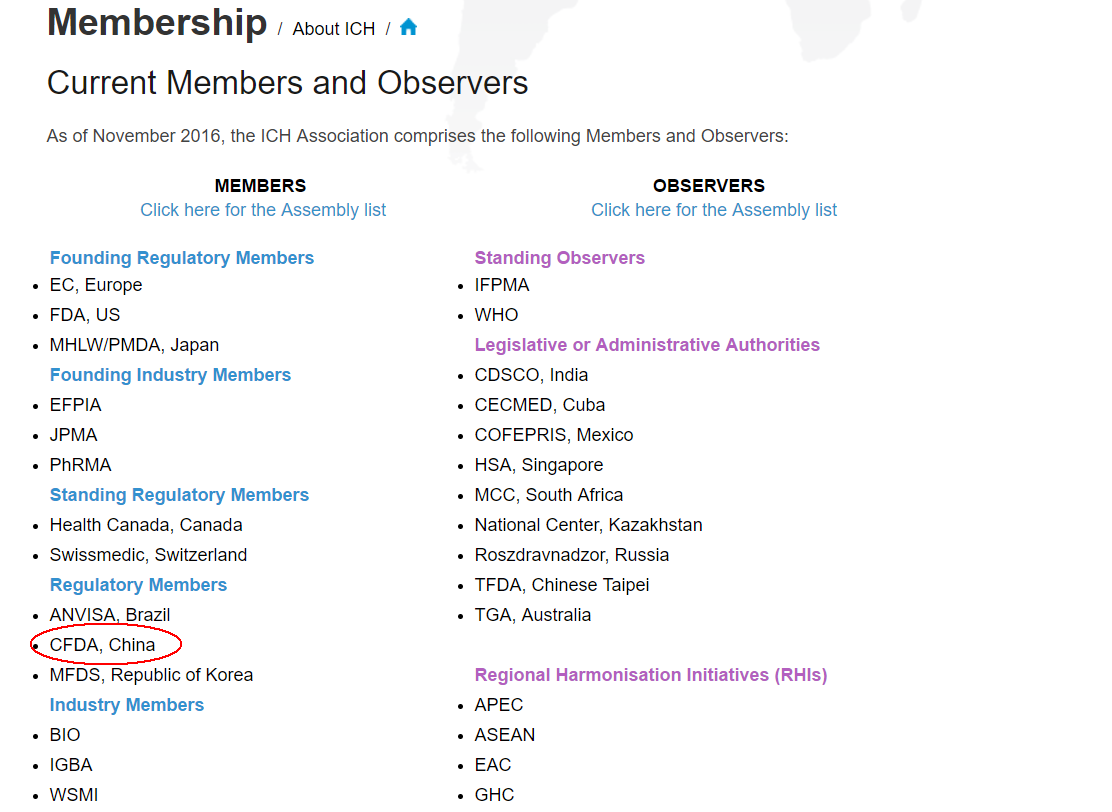
2017年5月31日至6月1日,国际人用药品注册技术协调会(ICH)2017年第一次会议在加拿大蒙特利尔召开。会议通过了国家食品药品监督管理总局的申请,正式批准总局成为其成员。6月14日,经报国务院批准,国家食品药品监督管理总局局长毕井泉致函ICH管理委员会主席穆林博士,正式确认加入ICH,成为其全球第8个监管机构成员。
【特别报道】
2014年11月,CFDA在ICH里斯本会议上表达了加入意愿
2017年3月,CFDA正式提出以成员身份加入的申请
2017年6月1日(蒙特利尔时间),ICH闭门表决同意CFDA加入
2017年6月14日,经报国务院批准,CFDA正式确认加入ICH
“
加入ICH,既是总局落实习近平总书记关于食品药品监管“四个最严”要求中 “最严谨标准”的具体举措,也充分体现出国际社会对中国政府药品审评审批制度改革的支持和信心。
”
【发起成立】
1990年由美国、欧共体和日本三方药品监管部门和行业协会共同发起成立,于2012年启动改革,并最终于2015年12月由一个封闭的国际会议机制,转变成为在瑞士民法下注册的技术性非政府国际组织。【当前组成】
成员(Member):15家(含CFDA)
观察员(Observer):23家
【基本宗旨】
在药品注册技术领域协调和建立关于药品安全、有效和质量的国际技术标准和规范,作为监管机构批准药品上市的基础,从而减少药品研发和上市成本,推动安全有效的创新药品早日为患者健康服务。
【正在开展工作的工作组】20个
【中国已转化ICH指导原则】28个
【指南文件】(数量)
质量Q系列(27),主要为稳定性研究、杂质限度和更灵活的GMP,风险管理的质量方法等。
安全性S系列(17),主要为致癌性、遗传毒性和生殖毒性等潜在风险等。
有效性E系列(21),主要为临床试验的设计、实施、安全性和报告,还涵盖新型生物技术衍生药物和使用药物遗传学/基因组学技术生产的靶向药物等。
多学科M系列(10),主要为《ICH国际医学用语词典》术语集(MedDRA),通用技术文件(CTD)和电子监管信息转移标准(ESTRI)等。
“
加入ICH,意味着中国的药品监管部门、制药行业和研发机构将逐步转化和实施国际最高技术标准和指南,并积极参与规则制定,将推动国际创新药品早日进入中国市场,满足临床用药需求,同时提升国内制药产业创新能力和国际竞争力。
”