临床“默许制”落地首月,中国1类新药默示许可获批概况
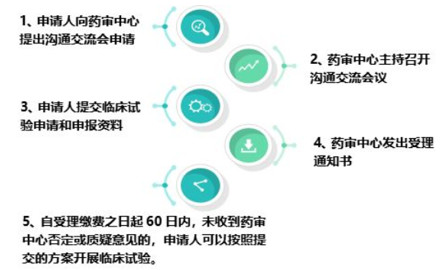
2018年7月27日《国家药品监督管理局关于调整药物临床试验审评审批程序公告(2018年第50号)》公布。按照公告,临床审评审批默示许可制度为:在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到国家食品药品监督管理总局药品审评中心否定或质疑意见的,可按照提交的方案开展药物临床试验。这标志着中国的新药临床试验行政许可将进入更加高效的审评模式,将由过去的审批制开启默示许可制度。
按照公告具体流程如下:
2018年11月5日,第一批获得默许的受理号公布,共8个,可在CDE官网热点栏目“临床试验默示许可公示”查询到默示许可受理号及品种。这标志着“默许制”正式落地。至12月4日,“默许制”刚好落地一个月,又有哪些中国1类新药默示许可获批呢?
现在热点栏目中的“临床试验默示许可公示”变成了“临床试验通知书查询“,里面名字仍然是”临床试验默示许可“(列表中的受理号并不按公示时间显示)。
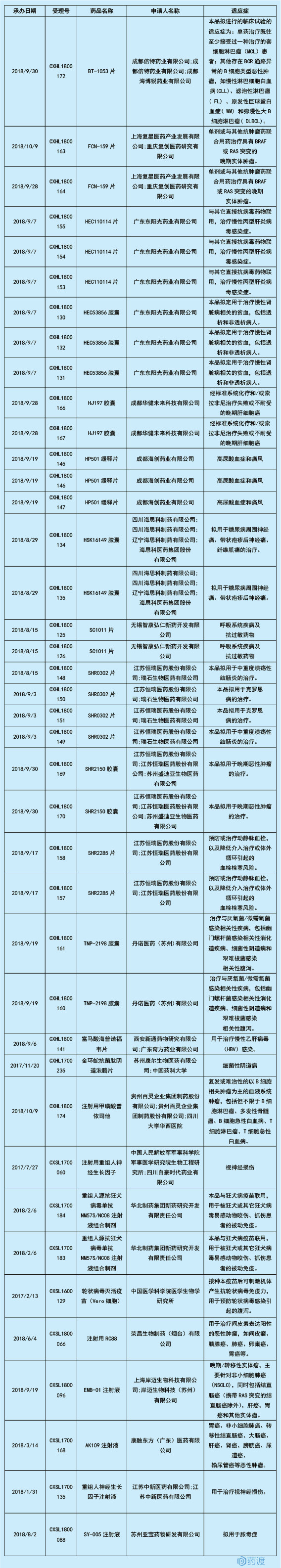
临床试验默示许可栏目中,至2018年12月4日晚,共有103条记录,所包括的受理号,不仅局限于临床申请,也包括仿制药中的生产申请。从中筛选出中国化学和生物新药,其中生物15条,化学药34条。其他受理号,中药占1条,非1类新药;进口药占36条(无补充申请在),共23个品种,其中生物药10个(2个疫苗);中国仿制药占17条,其中生产申请10条,补充申请6条,1个是以T结尾的申请。
对这49条化学和生物新药受理号进行筛选,其中中国1类生物药9条,共8个品种,中国1类化药31条,共15个品种,恒瑞的JAK抑制剂SHR0302已处于临床II期,其余均为刚获批或处于初期阶段。具体如下表所示,从中我们可以看出同一品种制剂获得默示许可通过,可原料药的并未公示,获批最快的为MEK抑制剂FCN-159和HDAC抑制剂甲磺酸普依司他,于2018年10月9日承办。这两个品种均非特殊审批类型。其中最为明显的趋势是,化药绝大多数为2018年8、9月份受理的,9月份高达22个,共10个品种。生物药占比少,大部分于2018年受理。由此可见高效的审评模式明显加速药物研发进展。
就品种而言其中不乏热点、新机理药物,丹诺医药的TPN-2198有独特的多靶点作用机理,可克服耐药性并降低耐药菌的产生。岸迈生物基于FIT-Ig?专利平台技术开发的双特异性抗体EMB-01也值得继续关注。岸迈生物去年A轮融了2500万美元,目前在与药明生物就此药展开合作。在此就不一一列举各个有意思的品种了,本文主要整理出1类新药,作为后续关注要点。