CRO:多重利好催生行业高景气
我国CRO(合同研发组织)行业迎来黄金发展期。
近年来,随着我国药品注册审评速度加快和仿制药质量和疗效一致性评价的推进,医药行业对研发外包服务的需求大为提升;同时,我国相对低廉的临床试验成本,也吸引国际研发外包服务订单向我国转移,促进了我国CRO的蓬勃发展。
研发服务需求旺盛
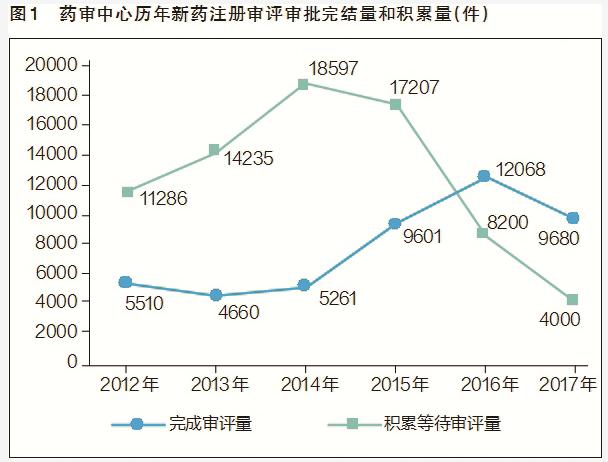
近年来,我国药品审评审批速度不断提高,新药审批等待时间大幅缩减。从药品审评中心(CDE)公布的历年药品审评报告可以看出,药品注册申请审评审批速度明显加快,从2015年之前的年均5000件审评完结量大幅提升到2017年的1万件左右;积压等待审评量从2015年高峰期的2.2万件下降到2017年的约4000件(见图1),目前注册积压已逐步消除,90%的药品注册申请实现了法定时限审评。
此外,2016年,国家药品监管部门出台了《关于解决药品注册申请积压实行优先审评审批的意见》,将多种情况纳入优先审评范围,其中包括防治艾滋病、肺结核、病毒性肝炎、罕见病、恶性肿瘤的药物以及儿童老人急需的“救命药”的注册申请。截至2018年8月,药审中心已公开发布31批410个列入优先审评审批的品种。优先审评审批制度的建立,有效疏通了注册审批通道,缓解了我国药品注册过程等待时间过长问题。这些举措都有利于提升CRO行业潜在的客户需求。
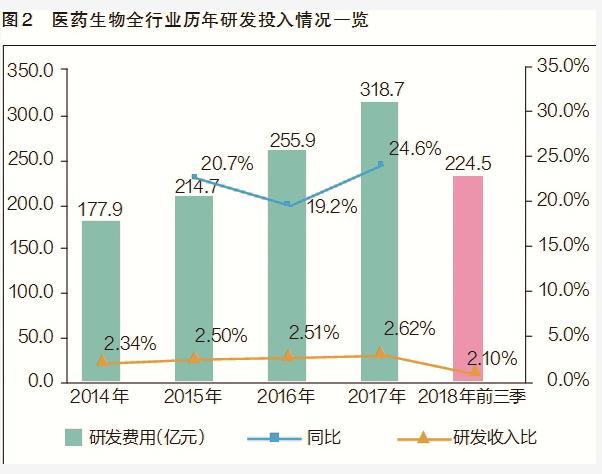
近年来,我国生物医药行业上市公司研发投入持续加大,不论是绝对数还是研发收入占比,都呈现出上涨趋势。2015年,行业整体研发投入突破200亿元大关,达到214.7亿元,同比增长20.7%,研发收入比为2.5%;2016~2017年,研发投入年增速高于营收增速,2017年研发投入突破300亿元,研发收入比上升到2.62%;2018年前三季度,全行业研发投入总额达到224.5亿元,研发收入比约为2.1%(见图2)。研发投入的快速增长,直观反映出企业研发需求的旺盛程度。
此外,仿制药质量和疗效一致性评价工作,也使研发外包服务的需求迅速增长。2016年3月,国务院办公厅发布《关于开展仿制药质量和疗效一致性评价的意见》,规定化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。仿制药一致性评价主要包括药学等效(PE)和生物等效(BE)两部分,我国大部分药企不具备自行开展一致性评价的资源和能力,少数大型药企虽有能力自行开展相关研究工作,但旗下拥有众多产品批文,需要进行一致性评价研究的工作量巨大。时间就是效益,谁先通过一致性评价,谁就将抢占市场先机。在此背景下,CRO业务量大幅增长。
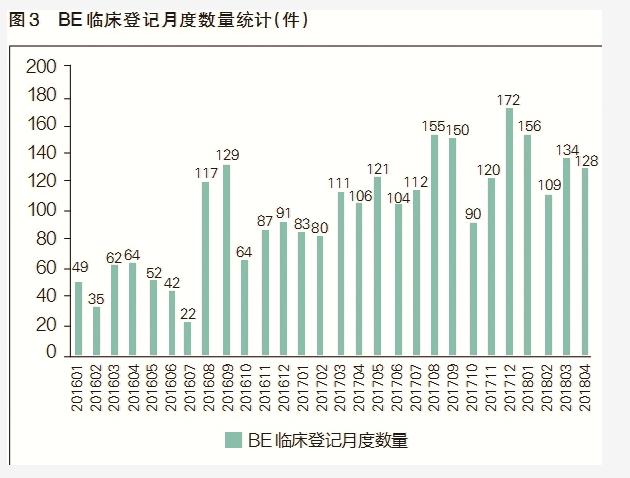
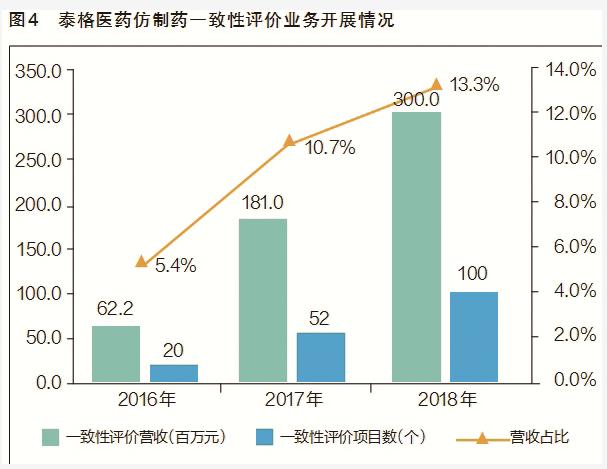
药智网统计数据显示,BE临床新登记月度数量从2016年8月开始大幅增加,到2018年4月一直保持着较高的数量,这从侧面反映出一致性评价工作正在加速(见图3)。仿制药一致性评价为CRO行业带来了明显的业务增量,以泰格医药为例,2016年,该公司仿制药一致性评价收入约为6220万元,仅占其营收总额的5%左右;2017年,来自仿制药一致性评价的业务收入大幅提升到1.81亿元,同比大增190%,营收占比提升到10.7%;2018年全年,预计该公司完成了约100个一致性评价项目,营业收入有望超过3亿元(见图4)。
国际CRO向中国产业转移
低成本、庞大的人口数量和丰富的疾病谱优势,促使国际CRO正在向中国进行产业转移。
目前,全球新药研发难度不断提高,高投入、长周期、高淘汰率始终伴随新药研发全过程。同时,跨国药企现有专利药将在未来几年内专利保护集中到期,专利悬崖将导致仿制药冲击专利药原有市场,降价和市场被蚕食将不可避免。跨国药企为降本增效,有动力在持续高投入新药研发的基础上,寻求低成本的各类研发外包服务。国际新药研发CRO正在经历向包括中国在内的亚洲低成本国家和地区进行产业转移的浪潮。
我国研发成本优势体现在高素质低成本的专业人才获取和低成本的临床病例两方面。
我国每年高校毕业人数超过700万人,硕博研究生招生人数超过60万人,拥有大量后备专业人才储备;近年来,有大量海外具有丰富从业经验的各类医药外包服务人才回流国内。同时,我国人均收入水平远低于欧美发达国家和地区,高素质低成本的专业人才获取,为人才与技术密集型的CRO行业带来了竞争优势。
我国还有庞大的病患人群和丰富的疾病谱,在疾病种类多样性和病例数量方面拥有其他国家所不具备的条件,足够数量的临床试验病例召集和临床终点完成,相比欧美发达国家和地区都有优势;尤其是在一些罕见病或需要长时间临床终点的癌症等疾病方面,可入列的临床病例数多,增加了临床试验研究的可靠性和统计学意义。
同时,我国取得临床病例的成本也相对较低。据Business Insights发布的研究报告,将各类药物的临床试验数据平均来看,2010年在美国完成1例一期临床试验所需要的综合成本约为6000美元,二期临床试验约7000美元,三期临床试验约8000美元。在中国,进行临床试验完成一例合格病例所需要的成本通常不超过20000元人民币(约3000美元),大大低于美国的临床试验成本。低廉的研究成本吸引国外临床研究订单向我国转移。
相关上市公司方面,药明康德和泰格医药是两家具有代表性的企业。药明康德是一家覆盖新药研发和生产全流程的CRO/CMO(合同生产组织)企业,其优势在于CRO领域的上游新药分子开发和筛选以及CMO领域(由其子公司合全药业执行),近年来,该公司也在逐步拓展临床CRO业务,以实现CRO、CMO全覆盖。泰格医药的优势主要集中在临床CRO方面。(李志新 作者单位:联讯证券)

















