2018资本热投三大领域:抗体药物/靶向药 罕见病 基因治疗
2018年是生物医药产业发展不平凡的一年。动脉网数据库显示,2018年全球医药健康领域共发生1410起投融资交易,涉及金额约388亿美元。这其中,生物医药类交易事件309起,交易金额达138.45亿美元。
抗体药物/靶向药物领域 频出高额融资事件
从2014~2018年生物医药领域投融资数据看,抗体药物/靶向药物、基因检测、免疫疗法和专项疾病治疗药物是目前最受资本关注的细分领域。其中,抗体药物/靶向药物以60.64亿美元的融资金额稳坐投融资热榜的“头把交椅”(见图1)。
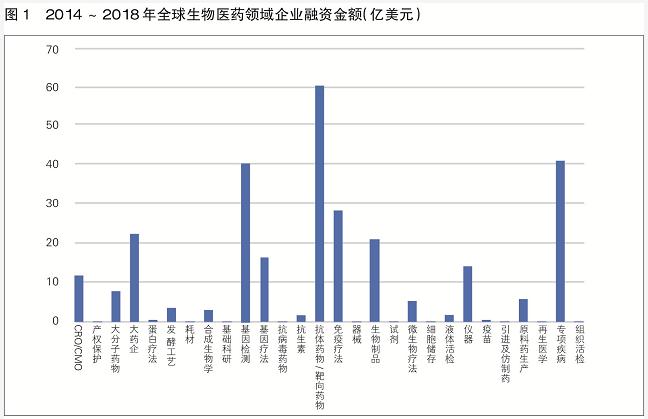
2018年,针对抗体药物/靶向药物的投融资事件共发生40起,平均每笔融资都在亿美元级,是高额融资事件的多发领域。肿瘤创新药的研发在近年来被视为新一轮药物研发的投资热点,抗体药物/靶向药物则是这一类投资热点中备受瞩目的细分领域。
靶向药物能够作用于肿瘤生长的特定目标,在对正常细胞伤害较小的情况下对肿瘤进行干预;抗体药物同样是利用靶向性、疾病的发展通路来干预疾病,具有更高的靶向性和疗效。
全球第一款靶向药物于1997年获批上市。发展到现在,靶向药物和抗体药物已经成为临床肿瘤治疗的重要手段。
不过,也正是由于这两种药物已经在临床广泛应用,大部分企业的发展已经进入中后期,竞争激烈、企业估值普遍偏高,大部分专注早期投资的机构或许不会再选择入局;对于专注后期的投资机构而言,现在正是收割的季节。
2018年,针对专项疾病治疗领域的投融资有75起,是投融资事件最多的细分领域。这些专项疾病大部分跟肿瘤、心血管疾病、神经退行性疾病有关。近几年,心血管疾病和肿瘤药物的研发一直都是投资热点。
相比之下,阿尔兹海默症的研究则更为前沿。
与糖尿病、心血管疾病类似,阿尔兹海默症的发病风险随年龄增长而增加。随着人口老龄化加剧,阿尔兹海默症造成的社会负担愈发突出。不同的是,糖尿病虽然仍不可治愈,但有可以控制病情的药物。而阿尔兹海默症的发病机制到目前为止仍不明确,亦没有治疗药物可用,是目前少数几种让人类束手无策的疾病之一。
2017年11月,比尔·盖茨以个人名义出资1亿美元用于阿尔兹海默症的治疗研究。他将其中的5000万美元用于注资风险投资基金Dementia Discovery Fund(痴呆症发现基金),另外5000万美元投资进行阿尔兹海默症研究的初创企业。
在2018年获得融资的机构中,有27家机构的业务与阿尔兹海默症相关,强生、礼来、药明康德、辉瑞、ARCH Venture、红杉、OrbiMed等一众知名药企和风投机构,砸下了近5亿美元的投资。
漫长的市场空白带来了两面性:一面是患者焦急的等待;另一面则是空前的机遇。近年来,阿尔兹海默症相关研究重大发现频出,专注生命科学早期投资的风投机构们已经开始出手,对专注前沿技术领域的机构而言,已经进入了筹谋规划时期。
基因治疗浪潮来袭 资本和创业公司抢占先机
2017年10月,Spark公司Luxturna的上市,让整个基因治疗领域的公司和资本都陷入了一场狂欢。这是第一款真正意义上的基因药物。在Luxturna上市的激励下,更多的资本和创业公司纷纷入场。
在企业端,据国际著名智库Jain PharmaBiotech发布的《2018全球基因治疗研究报告》,全球有超过183家公司正在从事基因治疗研究,有超过2000个临床项目。
基因治疗的临床研究可以追溯到上世纪90年代,由于早期的技术限制和对疾病的认知不足,基因治疗技术的发展一直不尽如人意。而随着基因剪切、病毒载体等基础技术的完善,人们对疾病、组织认知水平的提升,基因治疗的安全性、有效性都开始走向成熟。
先是新锐公司Spark率先取得突破,后是知名华人学者张锋、David Liu,以及J. Keith Joung三位基因编辑领域顶级科学家共同成立了基因治疗研究公司Beam Therapeutics,再后来,张锋参与的另一家基因编辑公司Editas Medicine宣布,获得美国FDA批准进行Leber先天性黑蒙10型(LCA10)的临床试验。
在经历了近30年的挫折后,基因治疗技术正在迅速发展,成为人类突破各种遗传性和获得性疾病的有力武器。遗传学免疫系统疾病、血液病、神经退行性疾病等,也是目前生物和化学药物研究难以突破的领域。
动脉网数据库显示,2018年全球共有17家基因治疗企业获得融资,资本在该领域投下了17亿美元。2019年2月25日,罗氏在其官网宣布重磅消息,将斥资43亿美元收购Spark Therapeutics,确保其在基因治疗领域处于领先地位,并保持血友病治疗业务的快速增长。这一消息为本已火热的基因治疗领域又加了一桶“热油”。
在我国,礼来亚洲、IDG等领先投资机构也已展开几轮布局。
孤儿药上市加速 制药巨头纷纷布局
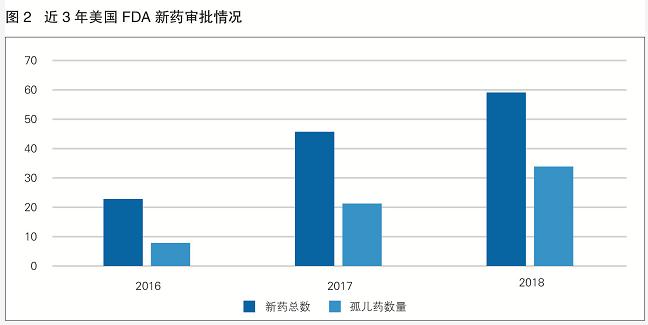
近年来,美国孤儿药上市加速(见图2)。2018年,美国FDA一共批准了59款新药,打破了20年来的最高纪录,其中有34款是作为孤儿药获批上市,占获批新药总数的57.63%。FDA首次批准了罕见遗传学软骨病、法布里病、苯丙酮尿症的治疗药物。
基于市场考虑,很多制药公司并不重视孤儿药的开发。美国于1983年立法,并通过了世界上第一部《孤儿药法案》(ODA)。该法案在市场独占权、临床优先权上给予孤儿药研发企业保护,并通过免除申请费用、提供研究基金和快速审批通道的形式为孤儿药研发企业提供便利。
除了美国,欧盟、日本、澳大利亚、新加坡等国家和地区也相继颁布了孤儿药法,这些法案极大地推动了孤儿药的研发和上市。
新药研发受到研发难度、药品专利期、仿制药等多种因素的影响,而罕见病药物的研发由于政策保护竞争较少,市场业绩往往表现不俗。比如,新基药业主要的销售额都来自其罕见病药物Revlimid,2017年销售额高达81.87亿美元。同年,默沙东PD-1销售额为38.09亿美元,还不及Revlimid的一半。
在研发成本持续上升、审批要求日益严格的背景下,罕见病药物开始成为制药巨头们的新选择。罗氏、新基药业、BMS(百时美施贵宝)、诺华、艾伯维、强生等药企,每年都有相当一部分研发费用用于罕见病药物的研发。
同时,日本武田制药2018年以640亿美元并购了罕见病药物巨头夏尔制药,对于此次收购,武田制药曾先后5次对夏尔提出报价函。2019年BMS对新基药业进行收购,交易金额更高达740亿美元。
随着孤儿药适应证的不断增加,Eculizumab、Imatinib Mesylate(格列宁)、Revlimid等重磅炸弹药物的出现也越来越多。EvaluatePharma曾预测,全球孤儿药的销售总额预计在2022年将达到2090亿美元,在处方药市场占比将达到21.4%,增速(2017~2022年的年复合增长率为 11.1%)将是整个处方药市场的两倍。
不过,即便政策支持、产业发展提速,目前已经审批或正在审批的药物对罕见病治疗而言仍是杯水车薪。目前全球已知有7000多种罕见病,仅5%的罕见病有了有效药物。罕见病治疗方兴未艾,还有更多的解决方案有待寻找,亦有更广阔的市场等待挖掘。(作者单位:动脉新医药)

















