群雄逐鹿PD-1/PD-L1抗体专利
PD-1/PD-L1抗体是当前肿瘤免疫治疗领域最受关注的热点之一,在我国已有4个药物获批上市,分别是百时美施贵宝的纳武利尤单抗注射液(Opdivo)、默沙东的帕博利珠单抗注射液(Keytruda)、君实生物的特瑞普利单抗注射液、信达生物的信迪利单抗注射液,此外,多款国产生物类似药已提交上市申请。而如何进行PD-1/PD-L1抗体的专利布局,也是近年来国内外药企关注的重点。
我国专利申请趋势
2017年1月,百时美施贵宝与默沙东就PD-1抗体全球专利战达成和解,作为和解协议的一部分,默沙东首期将向百时美施贵宝方支付6.25亿美元的费用,并将基于默沙东的Keytruda从2017年至2026年的全球(包括美国、英国、荷兰、法国、德国、爱尔兰、西班牙、瑞士、澳大利亚和日本)销售额,持续支付6.5%(2017年1月1日~2023年12月31日)或2.5%(2024年1月1日~2026年12月31日)的专利许可费。自此,百时美施贵宝与默沙东的PD-1抗体专利大战落下帷幕。
百时美施贵宝与默沙东进行的PD-1抗体专利大战,由于各个国家对PD-1抗体专利的授权标准、范围不同,基本没有波及我国市场。在国际市场激烈竞争的情况下,我国PD-1抗体药物迅猛发展,而国内各企业的相关专利申请布局情况则相对比较平静。
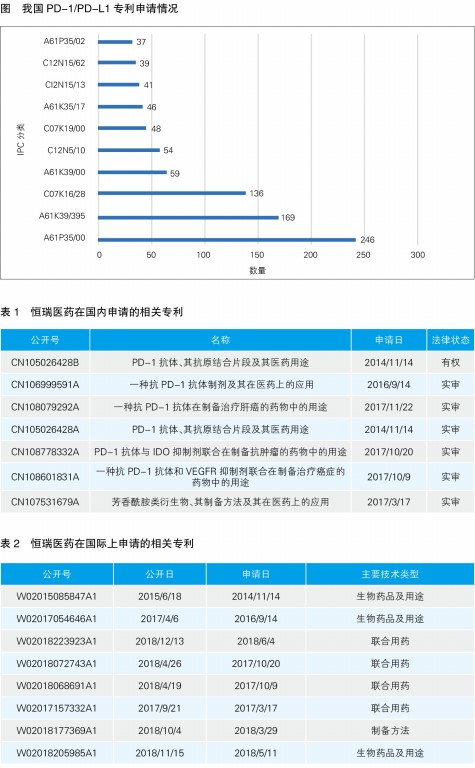
在我国,2014年以前以PD-1/PD-L1为靶点的药物的相关专利申请较少,趋势平缓;2014年,申请量开始增加,趋势陡升;2016年左右,申请量最多,接近160件,达到顶峰;近两年申请量有所下降。由申请的技术类型可以看出,国内PD-1/PD-L1抗体专利的授权范围多为国际专利分类(IPC)中的A61P35/00 抗肿瘤药,其次为A61K39/395抗体、免疫球蛋白、免疫血清等(见图)。具体保护范围包括抗体的序列片段、组合物、用途、方法、医疗器械等具体而狭小的某一方面的产品或用途,而涉及功能性保护较广的授权范围在我国很难拿到专利授权保护。例如,在百时美施贵宝与默沙东PD-1抗体专利大战中的关键性专利Opdivo的基础专利WO2004004771A1,该专利权利要求利用功能性限定“通过抑制PD-1,PD-L1或PD-L2等免疫抑制信号通路而使免疫增强的方法治疗癌症或者感染”保护了相当大的范围,这在我国是很难获得授权的。
国内企业纷纷“出手”
近年来,国内企业积极布局PD-1/PD-L1抗体有关专利。
恒瑞医药具有较强的知识产权保护意识,不仅在国内布局抗体产品、用途、制剂、组合物及联合用药等多方面专利,也非常重视海外市场的专利布局,相继到美国、澳大利亚、巴西等国家和地区申请相关专利(恒瑞医药在国内外申请的专利情况见表1、表2)。
百济神州在我国申请的5件专利中,目前已有1件获得授权。该专利权利要求为 “一种抗体或其片段,所述抗体或其片段特异性结合人类PD-1且包含以下6个互补决定区(CDR),其中CDR-H1的序列如序列编号31所示、CDR-H2的序列如序列编号32所示、CDR-H3的序列如序列编号33所示、CDR-L1的序列如序列编号34所示、CDR-L2的序列如序列编号35所示和CDR-L3的序列如序列编号36所示。”该专利保护范围较具体,且没有布局任何周边相关专利,专利保护力度较弱。百济神州从2015年开始在海外进行专利布局,分别在美国、韩国、印度等国家和地区,就生物药产品、组合物、联合用药、适应证、制备方法等申请专利保护。如果想在激烈的PD-1抗体市场竞争中获得优势,企业需在国内外同时扩大专利保护网络,加强知识产权保护力度,且在面对激烈的海外竞争时做好专利防御及主动进攻的专利策略。
信达生物在国内布局了PD-1单抗产品、用途、组合物、适应证等一系列周边专利,目前这些专利均在实审状态,尚无授权专利,知识产权保护力度较为薄弱。国际专利布局方面,已在欧洲、澳大利亚、加拿大等国家和地区提出专利申请,申请日期多在2016年以后,目前尚未有授权专利。建议加强研究,尽早申请专利,并利用一切方法延长专利保护期,以防竞争对手抢占先机。
君实生物于2013年获得苏州君盟生物医药科技有限公司的专利CN104250302B,其权利要求保护了:“1. 能够结合PD-1的抗体或其功能性片段,其重链CDR1、CDR2和CDR3以及轻链CDR1、CDR2和CDR3的氨基酸序列选自以下各氨基酸序列的组中的一组。2. 权利要求1所述的抗体或其功能性片段,其包含选自氨基酸序列SEQ ID NO:19,21, 23的重链可变区,和选自氨基酸序列SEQ ID NO:20,22,24的轻链可变区。”该专利保护了几组具体的氨基酸序列、片段、载体、制备方法及适应证乳腺癌或黑色素瘤。
君实生物另一篇专利CN108456251A权利要求为:“1. 抗体或其功能性片段,其包含选自氨基酸序列SEQ ID NO:7,8,9,13,14,15,19,20,21 ,22,23,24,28,29,30或任何所述序列之变体的重链CDR,和/或选自氨基酸序列SEQ ID
NO:1,2,3,4,5,6,10,11,12,16,17,18,25,26,27或任何所述序列之变体的轻链CDR。2. 权利要求1所述的抗体或其功能性片段,其中所述重链CDR的CDR1、CDR2和CDR3的氨基酸序列选自以下各氨基酸序列或其变体的组中的一组:
HCDR1 HCDR2 HCDR3A SEQ ID NO:7 SEQ ID NO:8 SEQ ID NO:9B SEQ ID NO:13 SEQ ID NO:14 SEQ ID NO:15C SEQ ID NO:19 SEQ ID NO:20 SEQ ID NO:21D SEQ ID NO:22 SEQ ID NO:23 SEQ ID NO:24E SEQ ID NO:28 SEQ ID NO:29 SEQ ID NO:30和/或所述轻链CDR的CDR1、CDR2和CDR3的氨基酸序列选自以下各氨基酸序列或其变体的组中的一组。”
对比以上两专利可以看出,君实生物在2017年申请的PD-L1抗体专利扩大了序列范围,扩展了结合PCSK9的抗体联合用药的新用途。尽管如此,相较注重知识产权保护的跨国公司,君实生物在PD-L1抗体药物的专利保护方面在国内较为薄弱(仅有三篇相关专利),海外市场分别进入美国、巴西、印度,海外专利保护力度较为薄弱,专利保护力度仍需加强。
专利布局越早越好
从国内药企申请的PD-1抗体有关专利信息可以看出,相较于跨国企业全面且坚实的专利壁垒,国内企业对于知识产权的布局尚处于起步阶段,唯有恒瑞医药有重视海外市场专利布局的意识。国外企业在PD-1靶点研发与专利布局的策略,值得国内企业参考学习。
一方面,国内企业在生物药方面投入的人力、物力、财力逐渐加大,在研发前期即应将专利布局提上日程,尽早保护核心专利,同时申请周边专利,编织一个合理、有效的专利保护网,从而使自身的利益最大化。
另一方面,更要重视后续的研发。企业可以对已经公开的专利技术进行相应改进,如抗体功能区氨基酸的突变、结构的改变、提高生物活性等一系列产品技术的改进;对相应剂型、组合物、适应证、制备方法可以进行更多的尝试。同时,要对改进的新技术及时申请专利进行全面保护,构建自己的专利网,必要时通过专利诉讼、专利复审等法律手段达到和解机会或交互许可的目的,实现与竞争对手相互制衡,以便在未来的市场竞争中占据一席之地。(赵晶 赵琨)

















