5个产品有望加入优先审评行列,罕见病药物氨己烯酸片受关注
中国食品药品网讯(记者落楠) 3月21日,国家药品监督管理局药品审评中心网站拟优先审评品种公示栏目发布的5条信息显示:扬子江药业集团江苏制药股份有限公司的恩替卡韦口服溶液、成都苑东生物制药股份有限公司的盐酸美金刚缓释胶囊(规格为7mg与28mg)、远大医药(中国)有限公司的氨己烯酸片、北京四环制药有限公司的醋酸艾司利卡西平片有望加入优先审评行列。
与2月25日、26日药审中心发布的7条信息显著不同的是,这5个产品均为国产药品。其中,远大医药的罕见病治疗药物氨己烯酸片引人关注——进入优先审评通道的国产罕见病药物名单或将更新。
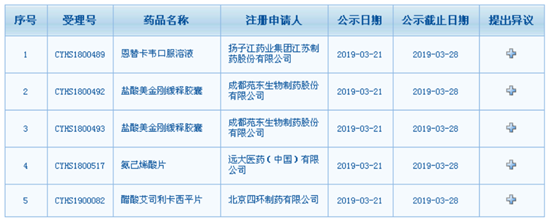
图为拟优先审评品种公示栏目更新的5条信息。
相关统计显示,我国有2000多万罕见病患者。因患病人群相对少、研发成本高等原因,以往制药企业对罕见病药物鲜有关注。事实上,我国罕见病药物的市场潜力不可谓不大,业界曾有评估,如果中国医保报销制度参考日本模式,考虑到人口数量,国内罕见病药物最大市场潜力约为396亿美元。
近年来,我国出台多项政策,鼓励罕见病药物引进和研发,本土企业纷纷深耕罕见病治疗领域:远大医药2014年与中国医学科学院药物研究所签署“罕见病药物研发”战略合作协议,共同研发10个品种的罕见病药品。北海康成构建罕见病药物研发与商业一体化平台,开发具有国际临床前沿水准的药物。此外,众多本土血液制品企业也积极投身罕见病药物研发。
救治罕见病实绩正在显现,罕见病药物市场规模扩大。据悉,目前远大医药已有5种罕见病药物完成药学研究。北海康成计划于2019年在中国递交首个开发适应证的临床试验申请。而据《中国罕见病药物可及性报告(2019)》,对照《第一批罕见病目录》涉及的疾病,2018年我国有多个国产罕见病药物进入优先审评通道,包括西安力邦制药有限公司的美法仑原料药及注射用美法仑,山西康宝生物制品股份有限公司、博雅生物制药集团股份有限公司和广东双林生物制药有限公司的人凝血因子VIII,南岳生物制药有限公司的人凝血酶原复合物,山东泰邦生物制品有限公司的人凝血因子Ⅸ,兆科药业(广州)有限公司的苯丁酸钠散,远大医药的卡谷氨酸片等。
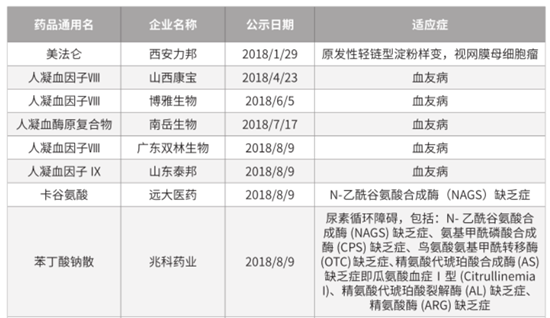
2018年我国多个国产罕见病药物进入优先审评通道。
2019年,国家对罕见病药物再发政策“红包”。今年3月1日起,我国对首批21个罕见病药品和4个原料药给予增值税优惠。国家医疗保障局《2019年国家医保药品目录调整工作方案(征求意见稿)》提出,罕见病治疗用药等药品将被优先调入目录。“加强罕见病用药保障”被写入2019年政府工作报告……种种迹象表明,罕见病药物研发风口已至,罕见病患者用药难、用药贵的状况将逐步改善。

















