自查报告填报系统开放至4月23日:15个药品面临临床试验数据核查
作者: 落楠
来源: 中国健康传媒集团-中国食品药品网
2019-04-16
中国食品药品网讯(记者落楠) 4月4日,国家药监局发布公告,决定对新收到的15个已完成临床试验申报生产的药品注册申请进行临床试验数据核查。4月10日,国家药监局食品药品审核查验中心发布通告,对相关品种药品注册申请人开放药物临床试验数据自查报告填报系统。

药物临床试验数据自查报告填报系统开放
按照核查中心发布的《关于开放药物临床试验数据自查报告填报系统的通告》,药品注册申请人应于2019年4月10日~4月23日,登录核查中心网站(www.cfdi.org.cn ),在公众服务区域选择“网上办事”中的“在线填报”,点击“临床试验数据自查报告填报”,或者直接访问网址:http://218.240.145.204:9082/esa/login_scqy.jsp,进行填报。逾期不报,将不安排现场核查。
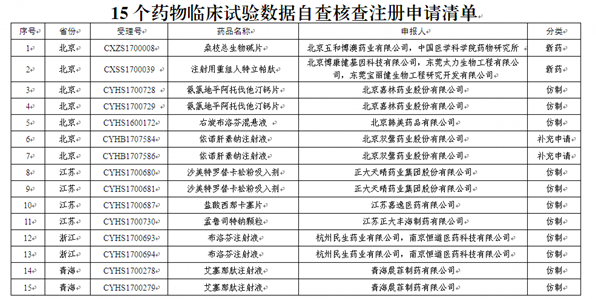
面临临床试验数据核查的15个药品
据悉,此次面临核查的15个药品,包括2个新药和多个有望冲击国内首仿的仿制药,涉及北京嘉林药业股份有限公司、北京双鹭药业股份有限公司、正大天晴药业集团股份有限公司等企业。按照国家药监局的公告,在国家药监局组织核查前,药品注册申请人自查发现药物临床试验数据存在真实性问题的,应主动撤回注册申请,国家药监局公布其名单,不追究其责任。

















