线下走向线上 医疗器械注册申报效率大提升

事件词云图
事件概述
2018年5月28日,国家药品监督管理局组织起草了《医疗器械注册申请电子提交技术指南(试行)(征求意见稿)》。经过近一年的征求意见,2019年5月31日,国家药品监督管理局发布公告,将于6月24日起正式启用医疗器械电子申报信息化(eRPS)系统,并同步公布《医疗器械注册申请电子提交技术指南(试行)》,以指导注册申请人/注册人通过eRPS系统进行电子格式申报资料的准备、提交和电子申请事项的管理。
根据公告,eRPS系统业务范围为国家药监局医疗器械注册事项,包括境内第三类和进口第二、三类医疗器械注册,注册变更、延续注册、第三类高风险医疗器械临床试验审批,以及医疗器械说明书更改告知、医疗器械注册及许可事项变更复审、创新医疗器械特别审查等。
媒体报道分析
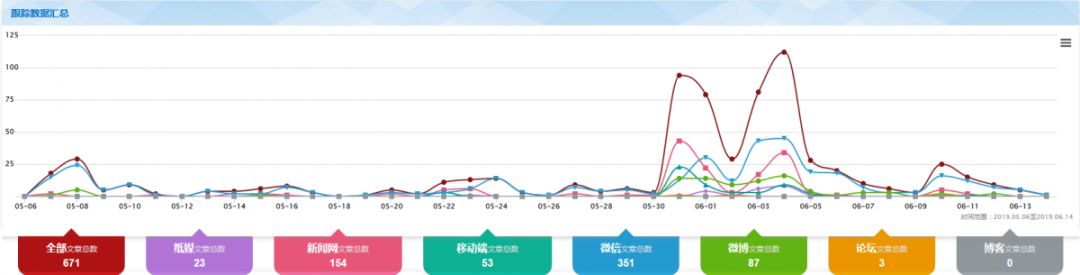
监测时间:2019年5月6日至6月14日
数据来源:中国健康传媒集团舆情中心
媒体报道主要聚焦以下3个方面:
关注电子注册申请的便利性
如中国食品药品网发表《6月24日正式启用!我国医疗器械注册电子申报进入倒计时》称,一方面,在企业人士看来,由于电子申报是封闭系统全程留痕,能增加申报资料的安全性,不用担心由于注册人员流失而导致的相关工作中断;明确的申报资料标准、细化的具体技术性要求,有利于企业在产品的设计策划阶段就考虑有关法规和技术要求,可间接提高生产企业的研发水平;数据实时查询,也可帮助企业对产品进行全生命周期管理。另一方面,器审中心质量管理部部长李耀华强调,电子申报客观上对申报资料质量提出了规范的要求,使用人员如果不能按照规定的格式要求制作电子格式申报资料或未遵从相关的操作程序,可能会导致电子格式申报资料无法在eRPS系统中有效加载、上传。
关注对医疗器械产业的深远影响
如南方都市报客户端发表《国家药监局拟启动医疗器械注册电子申报,将助力医疗器械上市后监管》,文章援引国家药品监督管理局医疗器械技术审评中心副主任卢忠的观点称,中国作为国际医疗器械监管机构论坛(IMDRF)成员国之一,实质性参与到了医疗器械注册申报规范目录(RPS ToC)的制定中。eRPS系统将植入该目录,这种结合将为医疗器械行业的发展、监管带来“深远影响”。第一,提高技术审评效率;第二,有利于申请人在国际范围内申报上市;第三,间接提高了生产企业的研发水平。
关注针对eRPS系统的免费培训
如微信公众号“赛柏蓝器械”发表《刚刚!国家药监局发文,医械注册电子申报将启动》称,国家药品监督管理局和医疗器械技术审评中心通过政策解读专题培训、定向培训、现场帮助、系列答问、公众号推送等多种方式,免费帮助行政相对人从纸质资料提交到线上电子申报的整个过度。另外,国家器审中心正免费向境内第三类医疗器械申请人/注册人和进口医疗器械生产企业的代理人发放免费的CA,配套用于 eRPS系统。器审中心将通过CA领取阶段的意愿调查,提前收集和掌握行政相对人的申报意愿,有针对性地组织有关eRPS系统使用的培训与指导。

















