罗氏召回中国市场凝血试纸 检测偏差或影响心梗用药剂量
日前,罗氏诊断产品(上海)有限公司主动召回我国进口的凝血酶原时间检测卡(电化学法),涉及4个货号、9个批次、2500盒(每盒规格分别为6条、24条、48条),召回级别为一级召回。国家药品监督管理局、国家卫生健康委员会均发布了召回消息。
罗氏召回的凝血试纸外包装盒(图片来自FDA网站)
记者了解到,凝血酶原时间检测卡使用方法与血糖仪的试纸类似,用于体外对指尖采得的毛细血管血和未经抗凝处理的静脉血进行凝血酶原时间的定量测定。如,将指尖血置于检测卡上,放入检测设备中即可获得国际标准化比值(INR),以调整华法林等维生素K拮抗剂的服用剂量。华法林适用于预防和治疗血栓栓塞性疾病,也是心肌梗死的辅助用药。其INR数值受许多因素影响,需要严密监测。也就是说,检测设备和检测卡的准确性对华法林的剂量调整是否准确至关重要。
罗氏诊断产品(上海)有限公司称,罗氏诊断总部近期收到检测结果数值偏差的投诉,调查发现,这是由于世界卫生组织(WHO)更新了参考标准品。使用2016新版WHO参考标准品(rTF/16)进行校准的产品检测结果,与使用原2009版WHO参考标准品(rTF/9)进行校准的产品检测结果之间存在偏差。召回涉及国家和地区为全球召回。
12月4日,国家药监局发布罗氏诊断产品(上海)有限公司召回信息。
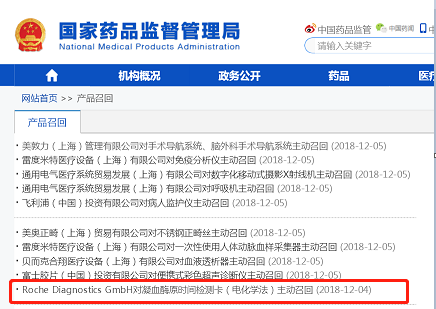
12月26日,国家卫健委发布通报,称收到国家药监局来函,通报凝血酶原时间检测卡(电化学法)部分产品召回有关情况。要求及时通知各医疗机构做好相关型号、规格及批次的召回工作,保证医疗质量和医疗安全。
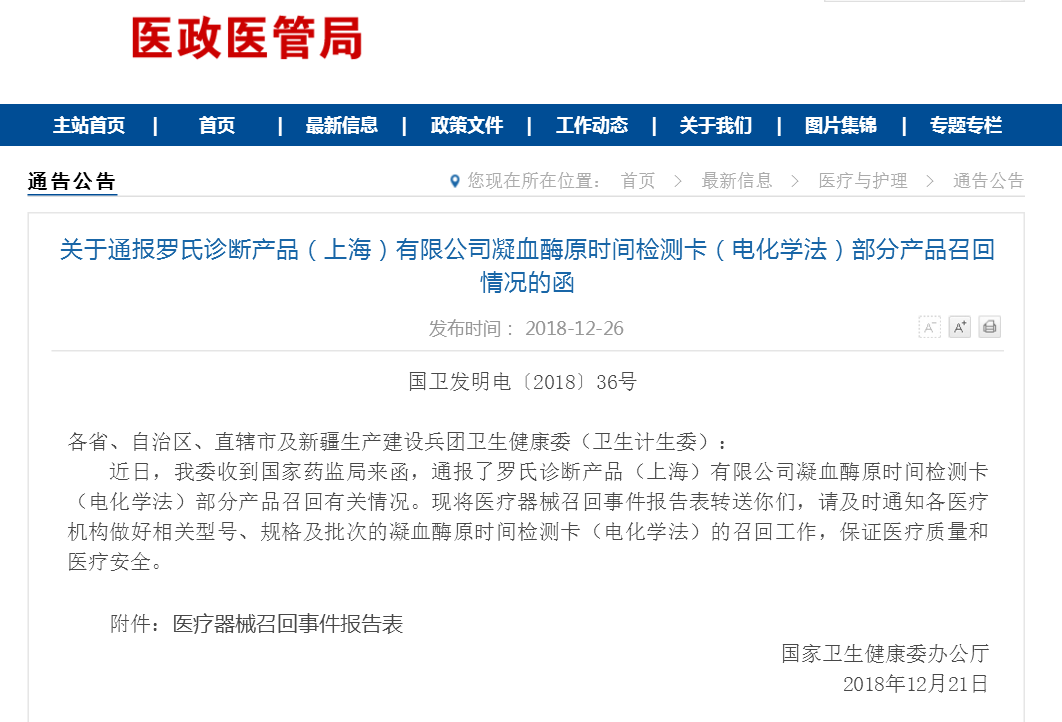
记者获悉,9月以来,美国FDA发布罗氏该产品召回信息,一共3次,均为一级召回,涉及43个批次、110万盒(每盒规格分别为6条、24条、48条)。FDA设备和放射健康中心主任Jeffrey Shuren博士说:“这些检测卡被广泛使用,我们正在努力发出有关此次召回的警告。使用有缺陷的检测卡会导致严重的药物剂量误差,可能会导致一些患者严重受伤或死亡。我们还与公司合作,确保尽快将新的矫正检测卡分发给患者和医疗服务提供者。”
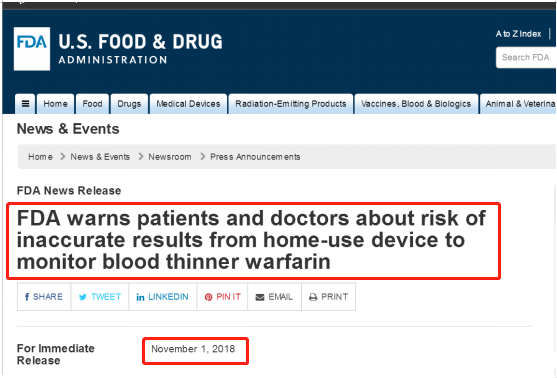
在美国FDA首次召回之前,罗氏通过供应商致消费者的信等形式,向美国、英国、爱尔兰、瑞典、荷兰等国家和地区的患者发出过安全警示信息。
8月28日,我国香港卫生署也发布了安全警示信息,呼吁市民留意由本地供应商罗氏诊断(香港)有限公司就其两款检测卡特定批号发出的安全警示。并称,罗氏诊断(香港)有限公司已向当地医院、私人诊所、医疗中心、大学和个体患者分发了大约180盒受影响的检测卡。
记者查询,我国香港受影响的批号范围与英国、爱尔兰、瑞典、新西兰等国家和地区所示范围相同,其中有的货号与中国医学科学院阜外医院周边一家药店所售货号完全一致,这家药店售价为1000元。
罗氏诊断产品(上海)有限公司称,未收到中国相关问题的市场反馈、客户投诉和不良事件,美国FDA根据风险评估结果,将罗氏总部上报的召回评估为一级。
罗氏诊断产品(上海)有限公司称,针对上述情况,采取五条纠正措施:
向经销商发布告知信,告知相关信息及需要采取的措施,并要求经销商向所有受影响客户发布告知信,告知相关信息及需要采取的措施;
将提供统一格式和内容的样板,要求经销商在其线下药店或网店发布召回信息;
将在公司官网上公布事件相关信息;
将在后续发货的所有凝血酶原时间检测卡(电化学法)产品中加放《致客户信》,告知事件的相关信息及要采取的措施;
罗氏诊断总部将使用原WHO标准品rTF/09对凝血酶原时间检测卡(电化学法)进行临时重新校准。(本报记者 王晓冬 马茗舒)

















