华海:主动召回当点赞 权威回应解心忧
牙膏常用,但牙膏监管“不常见”,公众对牙膏属于化妆品的监管范畴还很陌生。同样陌生的还有处方药成分的氨甲环酸。功效牙膏的成分、宣传等问题还需引起重视。
热议程度:★★★☆☆
▍事件概述
2018年7月6日,华海药业缬沙坦原料药中检测出亚硝基二甲胺(NDMA),引发舆论关注。随后,华海药业多次发布公告,说明事件进展及召回措施。期间,有自媒体传播不实信息,引起网民恐慌。2018年7月29日,国家药品监督管理局就该事件回应社会关切。2018年7月30日,国家卫生健康委员会发布通知,要求医疗机构做好配合召回和停止使用含华海药业缬沙坦原料药药品的有关工作。
2018年9月28日,美国食品药品管理局(FDA)、欧盟停止进口华海药业生产的原料药及制剂。2018年9月29日,华海药业回应仅限川南生产基地。
2018年11月8日,诺华旗下山德士公司召回一批氯沙坦氢氯噻嗪片,因其原料药中检出N-亚硝基二乙胺(NDEA)杂质,原料药为华海药业生产。2018年11月10日、12日,华海药业回应称,原料药杂质含量符合标准。
2018年12月11日,FDA公开了给华海药业的警告信,引发部分自媒体质疑此前华海药业公告与警告信内容不一致。2018年12月13日,华海药业就此进行澄清。
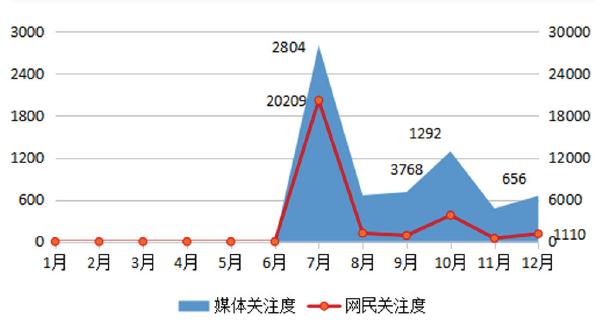
图1 “云南白药牙膏陷‘处方药’风波”舆情走势图
▍舆情走势
从整体舆情走势看,如图1所示,呈现“波浪式”特征,媒体关注度和网民关注度走势一致。
第一阶段:华海药业原料药中检出NDMA,国家药监局和国家卫健委相继回应,舆情出现第一次高峰
2018年7月6日晚,华海药业发布公告称,缬沙坦原料药中检出致癌物NDMA。之后,华海药业陆续发布4次公告,说明事件进展及召回措施。2018年7月22日,一些自媒体将事件与当时的“疫苗事件”相联系,夸大事件的严重性和危害性。2018年7月23日,华海药业发布澄清公告。全景网、界面新闻等进行转载。2018年7月29日、30日,国家药监局和国家卫健委分别就事件作出回应。新华网、中国新闻网等进行报道。
2018年8月初,润都股份和天宇股份供应给台湾客户的缬沙坦原料药中检出NDMA成分。2018年8月10日、13日,两家公司分别进行回应,界面新闻、第一财经等进行报道。
第二阶段:FDA、欧盟禁止进口华海药业原料药及制剂,舆情出现第二次高峰
2018年9月28日,FDA、EMA发布禁令,停止进口所有华海药业川南生产基地生产的原料药及制剂产品。2018年9月29日,华海药业发布情况说明称,FDA的禁令仅针对川南生产基地,其他原料药生产基地生产的产品不受禁令影响。2018年10月11日,微信公众号“医药手机报”发文称,FDA承认禁令只针对华海药业川南厂区。财联社、财经网、界面新闻等转发相关信息。此后,EMA因在印度两家药企生产的其他沙坦类药物中发现了NDEA杂质,将扩展审查范围。
第三阶段:山德士召回一批氯沙坦氢氯噻嗪片,舆情出现第三次高峰
2018年11月8日,诺华公司旗下山德士公司宣布在美国召回一批氯沙坦氢氯噻嗪片,因其原料药中含有NDEA,该原料药(氯沙坦钾)由华海药业生产。2018年11月10日、12日,华海药业发布公告称,山德士召回公告内容含糊,并未清晰完整地表述相关事实。公司原料药NDEA含量符合欧盟、FDA及日本公布的标准。新京报网、中金在线等发布相关信息。
第四阶段:FDA公开给华海药业的警告信引质疑,华海药业回应,舆情达到第四次高峰
2018年11月30日晚,华海药业发布公告称,收到FDA出具的警告信,针对重大不符合项进行汇总并提出整改要求。2018年12月11日,FDA警告信进行了公开。12日下午,雪球APP用户“汤诗语”发文称,缬沙坦杂质是客户发现而非华海自查;华海药业称是使用了某种溶剂导致出现杂质,但FDA研究发现,不使用该溶剂也会出现杂质,华海公司并未找到原因;华海将客户退回的原料药处理之后卖给了非美国客户。随后,微信公众号“赛柏蓝”“GMP办公室”等发文对警告信进行了翻译,并与华海药业公告进行了对比,相关信息助推舆情走高。2018年12月13日晚,华海药业从NDMA杂质发现过程、如何处理问题批次、是否存在相关未知峰未做调查、NDMA杂质产生原因调查4个方面进行了澄清。
▍舆情点评
此次事件源于企业的主动信息披露。华海药业的一系列公告、召回等行动也是在积极践行企业的主体责任。从舆情走势来看,华海药业或权威部门的发声是引起舆情波动的主要原因。同时,由于涉及药品相关知识,专业性较强,网民关注度整体较低。仅在谣言出现、国家药监局和国家卫健委发声、欧盟扩展沙坦类药物审查范围等有煽动性、权威性和新鲜性的话题出现时,网民关注度才会大幅上升。
值得注意的是,在华海药业披露信息不久,一些自媒体故意与当时的热点事件相类比,传播一些不实信息和夸张报道,恶意放大事件的危害性,激起了部分网民的恐慌情绪。信息的不对称导致了公众对用药安全的担心。因此,在类似专业性要求很强的事件中,在普通公众并不能十分理解个中道理的情况下,需要从他们关心的实际切身问题出发,及时给出明确的信息、实用的指导、有效的解决办法,才能更好的安抚公众情绪。
在事件发展过程中,不断有新的话题抛出,而且相关问题波及到了国内外更多的企业和产品。事件也逐步从一个由国内企业引发、国内外同步召回的用药安全事件上升到行业问题。
鉴于此,我国的药品监管部门应督促相关药企采取必要措施进行自查和整改,加强针对性的抽检,并在全国范围内加强对沙坦类药物的风险排查,防范风险。同时,加深对原料药生产工艺与检测技术的探讨,组织专家进行风险评估。此外,事件一定程度上对华海药业国内和国际市场造成影响,甚至使中国原料药在国际市场的形象下降,给中国药企在国际市场的竞争造成负面冲击。除了企业积极回应外,是否需要组织专家给予专业的解读,也是值得监管部门思考的问题。

















