FDA:2019年仿制药发展前景
2018年FDA仿制药批准数量在多个月份破纪录。2019年2月15日,FDA发布《竞争性仿制药疗法》指南草案,试图通过资格认定,激励缺乏竞争药品的仿制药研发上市,使患者获益。本文为FDA局长和仿制药办公室主任就2019年仿制药发展前景发表的讲话。各项政策和指南的颁布使美国仿制药的发展上了新台阶,未来竞争性仿制药疗法将为仿制药发展提供新动力。
2018年,FDA批准的仿制药数量占美国处方药市场份额的90%,同年10月和11月,FDA批准或预批准了1000多个仿制药,创下历史新高。“首仿药”,即FDA首个批准的与原研药疗效等效的仿制药。2018年首仿药批准数量达10%;“复杂仿制药”,或特别难以“仿制”的药品批准数量约占14%。
但仅从“批准的仿制药数量”并不能体现FDA在过去一年中在促进药品竞争和增加患者用药可及性方面所做的努力。FDA还推出了许多政策,通过为仿制药研发者提供关键指导和技术支持,促进仿制药市场竞争。
2018年,FDA发布了245个新的和修订的《特定药品指南》(product-specific guidances),这些指南为寻求研发原研药仿制药的申请人提供了更好的机会,以便有效地推进研发,并保证申请的完整性和高效。此外,FDA发布了73个与透皮和局部给药系统相关的特定药品(一种用于患者皮肤的复杂药品)指南,以及2个指南草案。由于透皮或局部给药系统药品的内在复杂性,研发这些药品的仿制药具有很大挑战,因此即使原研药专利到期或市场独占期结束,许多企业的透皮和局部给药系统药品仍不会面临仿制药的竞争。
FDA还实施了国会最近制定的新法定程序,以提高仿制药可及性,包括一个新资格认定——竞争性仿制药疗法(competitive generic therapy,CGT),其旨在加快缺乏充分竞争原研药的仿制药研发和审评。FDA于2018年授予6个获得CGT资格认定的仿制药市场独占期(对于某些首次批准的仿制药,授予180天市场独占期)。
注:“竞争性仿制药疗法”是为扩大仿制药市场竞争,加快原研药品的仿制药上市,减轻患者负担,增大患者用药可及性而实施的一项资格认定程序。企业可以针对某个缺乏竞争的药品提交仿制药申请,从而获得该药品的CGT资格认定。获得CGT认定的申请人可以与FDA召开药品研发会议,共同讨论研发过程可能遇到的科学问题,这将有助于缩短审评时间,加快仿制药上市。
FDA还实施一项新机制,即简略新药申请前(pre-ANDA)会议。这些会议主要针对研发人员,并关注复杂药品,以确保患者能够获得所需药品的仿制药。《仿制药使用者付费法案》(GDUFA II)的实施,为仿制药研发提供便利,同时pre-ANDA计划正在全面展开。2018年,FDA共收到91份pre-ANDA会议申请,比去年同类会议申请数量增加了三倍多。
此外,为现代化与行业交流的方式,FDA创建了CDER Direct NextGen合作门户网站,为潜在申请人提供了一种更有效的方式来申请pre-ANDA会议。2018年,FDA进一步加强了门户网站运营和维护,以接收、管理和跟踪仿制药生产商的申请,帮助申请人获取有关仿制药研发特定要素的信息(书面咨询)。2018年,FDA回复的书面咨询数量破记录;门户网站提高了一致性,简化了程序,促进了与潜在申请人进行重要沟通的分类和跟踪。通过以上以及其他重要活动,FDA致力于提高患者用药可及性。
《2018年FDA仿制药办公室年度报告》(The FDA’s 2018 Office of Generic Drugs annual report)全面介绍了FDA在2018年完成的所有工作,并指出2019年FDA将更好地完成这项重要工作。
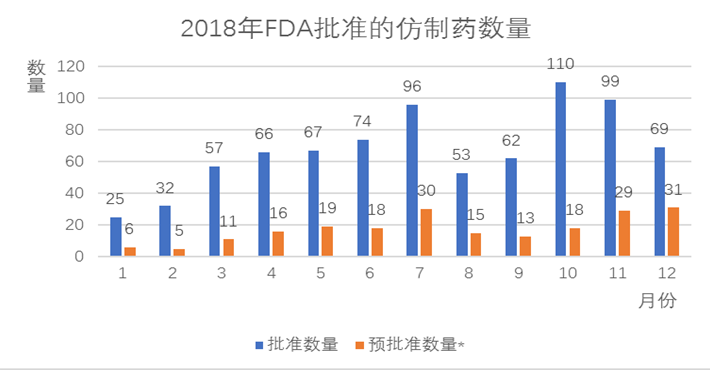
图1 FDA 2018年批准仿制药数量
注:“预批准”是指在原研药所有专利和市场独占期到期前,申请人不得销售仿制药并获得最终批准。
展望2019, FDA将继续努力,以确保美国公众能够获得安全、可负担的仿制药,包括推进其他政策以促进仿制药竞争,同时确保药品的安全性和有效性。FDA在提高审评效率和制定新政策以加快仿制药研发上市的同时,并没有降低仿制药审评的金标准。(作者:Scott Gottlieb;Kathleen “Cook” Uhl 编译:许文秀)
文章来源 https://www.fda.gov/NewsEvents/Newsroom/FDAVoices/ucm632128.htm

















