17个药品注册申请将迎现场核查 含9个优先审评产品
中国食品药品网讯(记者 落楠) 5月6日,国家药监局食品药品审核查验中心发布通告显示,计划对17个药品注册申请开展药物临床试验数据核查。这17个药品涉及糖尿病、慢性肾病等治疗领域,其中9个被纳入优先审评。
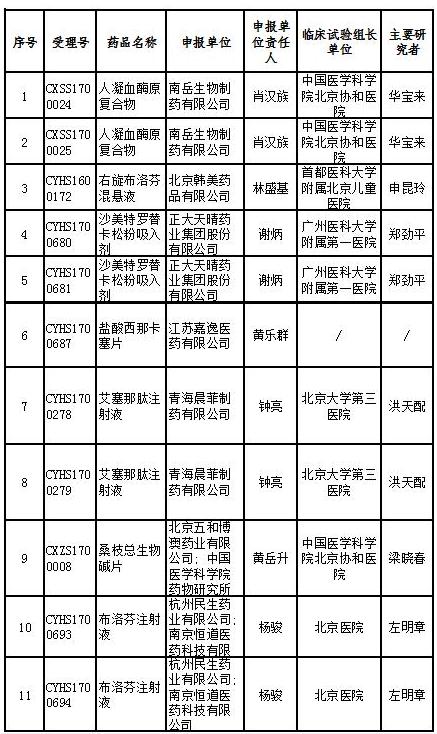
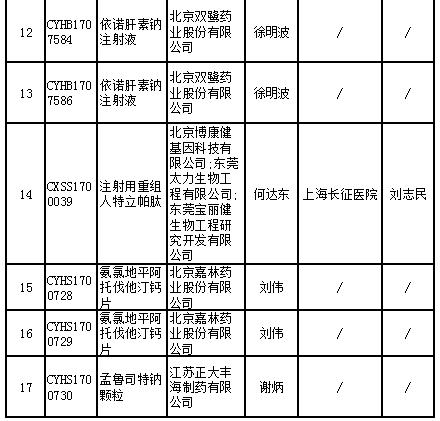
记者查询国家药监局药品审评中心官网发现,被纳入优先审评的品种中,人凝血酶原复合物(两种规格)是罕见病药物;右旋布洛芬混悬液、艾塞那肽注射液(两种规格)为列入《关于开展药物临床试验数据自查核查工作的公告》(原国家食品药品监督管理总局公告2015年第117号)的自查核查项目,申请人主动撤回并改为按与原研药质量和疗效一致的标准完善后重新申报的仿制药注册申请;沙美特罗替卡松粉吸入剂(两种规格)和桑枝总生物碱片被列入国家科技重大专项;盐酸西那卡塞片属于专利到期前1年的药品生产申请。
其他8个产品也或对国内市场产生较大影响。记者在国家药监局官网检索相关国产药品记录,发现目前布洛芬注射液的批准文号仅有两个,依诺肝素钠注射液有15条记录,注射用重组人特立帕肽、氨氯地平阿托伐他汀钙片尚无记录,孟鲁司特钠颗粒仅有1条记录。
通告显示,公示期为2019年5月6日至2019年5月17日。公示期结束后,即安排开展现场核查。
17个药物临床试验数据现场核查注册申请目录
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:齐桂榕)
















