医疗器械注册电子申报信息化(eRPS)系统电子申报目录解读
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)有关要求,国家药品监督管理局于近日发布《关于实施医疗器械注册电子申报的公告》(2019年第46号),医疗器械注册电子申报信息化系统(eRPS)即将启动运行。eRPS系统将我国现行医疗器械注册申报资料要求以国际医疗器械监管机构论坛(IMDRF)注册申报规范(RPS)项目的目录列表(ToC)形式完整展示,有利于指导注册申请人进行医疗器械注册申报资料准备,最大程度依托信息化系统方便行政相对人进行注册申报。
一、背景
中国现行的注册申报资料要求源于《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号公告,以下简称43号公告)和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号公告,以下简称44号公告)和相关规范性文件,医疗器械注册申请人需要按照43、44号公告的要求准备注册申报资料并提出注册申请。IMDRF的RPS项目工作组于2014年发布注册申报资料目录(Table of Content,ToC)并于2018年4月份进行了修订更新。此目录涵盖了国际上通用和各成员国的地区性特殊要求,且预期会成为国际医疗器械注册申报的统一目录要求,各成员国亦在积极的转化落地过程中。国家药监局高度重视在各级法规规章制定过程中充分考虑采纳或参考IMDRF各工作组的研究成果,eRPS系统的建设为我国将RPS-ToC目录的转化落地提供了契机。
二、研究
RPS-ToC包括医疗器械目录表(nIVDMA ToC)和体外诊断试剂目录表(IVDMA ToC),均分为6个章节,分别为第1章地区性监管信息、第2章申报产品综述、第3章非临床研究资料、第4章临床研究资料、第5章说明书标签和宣传材料、第6A章质量管理体系程序、第6B章产品的质量管理体系相关信息。每一章目录根据具体内容可划分不同层级。RPS-ToC文件在各级标题后备注有通用要求和地区性要求,并在各级标题后明确了具体的资料说明。各国在使用RPS-ToC时,可结合本国国情制定相应的分类列表以体现地区性监管差异。
通过对比分析RPS-ToC目录与我国43、44号公告对注册申报资料的要求,可发现两组文件虽然目录设置形式和层级不同,但通用的技术性要求基本一致。图1和图2分别将43、44公告中的申报资料要求列表与RPS-ToC相应的章节目录框架进行了交叉比对。
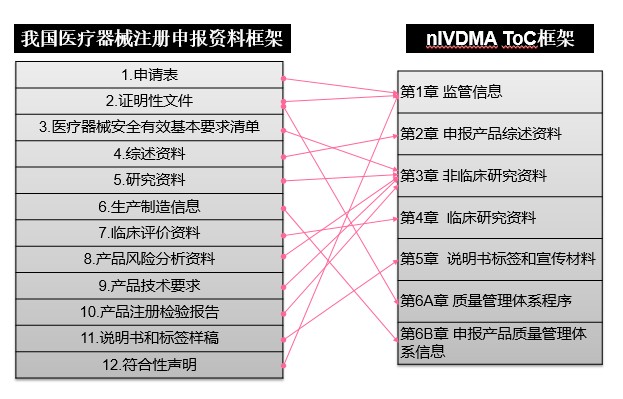
图1 医疗器械注册申报资料框架对应情况
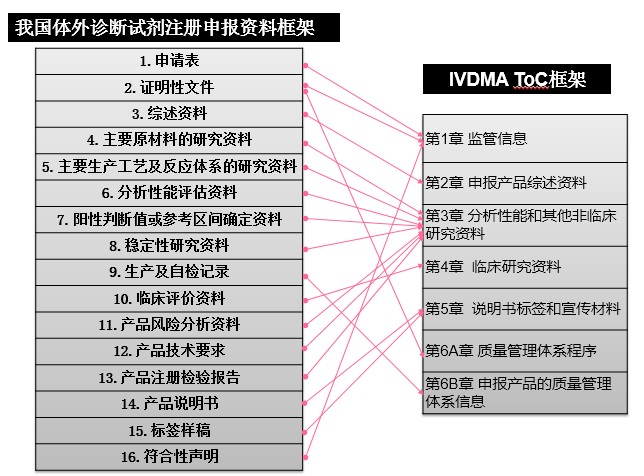
图2 体外诊断试剂申报资料框架对应情况
RPS-ToC文件第一章为监管信息,对应43/44号公告的申请表、证明性文件和符合性声明等内容。RPS-ToC文件第二章为申报产品综述资料,对应43、44号公告的综述资料。RPS-ToC文件第三章为非临床研究资料,对应43号公告的安全有效基本要求清单(EP)、技术研究资料、产品风险分析资料、产品技术要求、产品注册检验报告,对应44号公告的主要原材料的研究资料、主要生产工艺及反应体系的研究资料、分析性能评估资料、阳性判断值或参考区间确定资料、稳定性研究资料、产品风险分析资料、产品技术要求、产品注册检验报告。RPS-ToC文件第四章为临床研究资料,对应43、44号公告的临床评价资料。RPS ToC文件第五章为说明书标签和宣传材料,对应43、44号公告的说明书和标签样稿。RPS-ToC文件第六章为质量管理体系文件,对应43、44号公告中有关质量管理体系的证明性文件和生产制造信息。
三、应用
1. RPS-ToC文件将各章内各级标题逐级展开、细化,最多可到5级标题。nIVDMA ToC共有206个标题,IVDMA ToC共有210个标题。各层级标题后附有通用要求和地区性要求,并且在各章节后设置“其他资料”的申报空间。我国43号公告对于注册申报资料框架分为一级标题和二级标题;44号公告对于注册申报资料框架分为一级标题,并通过说明的形式以文字表述阐明各标题申报资料应包括的内容。RPS-ToC目录的章节设置及各章内的拓扑层级设置更为合理、清晰
2. RPS ToC文件中体外诊断类设备归属在IVDMA ToC中,在“CH3.6.1电气系统:安全性、机械和环境保护以及电磁兼容性”、“CH3.6.2独立软件/软件组件”等标题中体现对于体外诊断类医疗器械电气系统、软件的要求。我国的体外诊断类设备的资料要求执行43号公告,按医疗器械进行管理。因此eRPS系统的IVD电子目录关闭了有关体外诊断类设备的相关要求。
3. RPS ToC文件涵盖了所有成员国对于注册申报资料的要求,有些条款并不适用于我国情况或者我国法规并未对相应条款进行要求,差异内容主要体现在第一章和第六章。第一章中医疗器械唯一标识(UDI)、环境评价、临床试验证书、含有处方药或非处方药说明的适用范围声明等内容属于他国的地区性要求;我国在境内第三类医疗器械的注册质量管理体系核查、进口产品的质量管理体系证书等要求与第六章有关质量管理体系文件的要求也不尽相同。对于体外诊断试剂,我国法规并未要求提交EP清单、实质性等同结论等。eRPS系统电子提交目录充分考虑了这些差异内容,关闭了不适用的目录并对部分目录的资料说明按43/44的要求进行了适当修订。
4. RPS ToC文件的适用性提交属性包括必须提交(R)、适用性提交(CR)和无需提交(NR)三类。eRPS系统设置为:R目录必须上传文件否则无法成功提交;CR目录由申请人判断是否需要提交;NR目录设置为关闭状态,虽有目录展示但无需上传文件。
5.部分中国法规要求的文件在RPS ToC文件的地区性要求中无法找到合适的对应标题。本次eRPS系统建设充分考虑考虑了所有43、44号公告的要求,对个别目录的对应要求做了适当调整,保证中国法规要求的完整性。
6.关于第六章质量管理体系,目前RPS-ToC的要求明显高于我国43、44号公告有关质量管理体系认证的要求,eRPS系统中保留了第六章的目录,但根据我国法规要求关闭了其中多数子级目录,待下一轮法规修订完成后再结合实际情况开放相关资料提交的通道。
四、结论
eRPS系统电子提交目录将43、44号公告的注册申报资料要求以RPS-ToC的形式进行设置,目录层级和有关格式要求按照IMDRF相关的国际通用规范进行设定,但在具体申报资料要求方面基本保留了目前我国医疗器械注册申报资料要求,在充分考虑注册申报资料要求的延续性、方便注册申请人准备申报资料的同时,紧跟国际前沿,与国际通用的注册申报规范要求接轨,旨在提升我国医疗器械的研发水平,推动产业健康发展,提升国际竞争力。(作者:医疗器械技术审评中心 李耀华)

















