武田制药等6家企业申请注销15个药品批准文号
中国食品药品网讯(记者 郭婷) 6月13日,国家药品监管局发布公告,因企业主动申请,注销盐酸吡格列酮片、利福平等15个药品批准文号,涉及武田制药等2家外企和丽珠集团等4家本土企业。
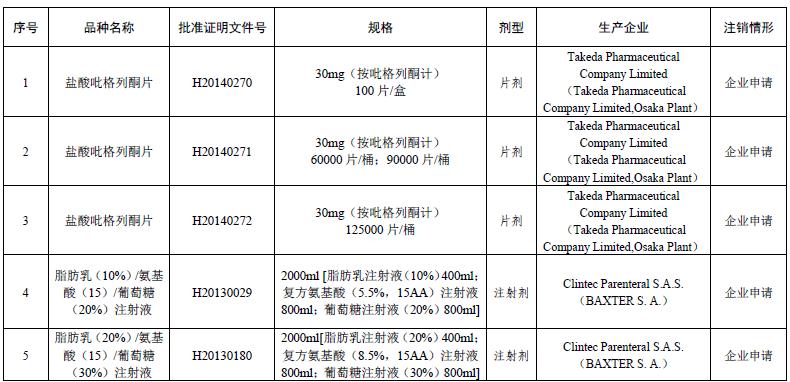
根据公告,日本的Takeda Pharmaceutical Company Limited(以下简称“武田制药”)申请注销了盐酸吡格列酮片【30mg(按吡格列酮计)100片/盒】【30mg(按吡格列酮计)60000片/桶;90000片/桶】【30mg(按吡格列酮计)125000片/桶】3种规格的批准文号,依次为H20140270、H20140271、H20140272。
记者查阅国家药监局网站发现,在2017年7月21日公布的《关于发布仿制药参比制剂目录(第八批)的通告》(2017年第116号)中,武田制药生产的盐酸吡格列酮片30mg(原研进口)被列为参比制剂。
目前国内共有10家企业持有15个盐酸吡格列酮片批准文号,这10家企业分别是上海凯宝药业股份有限公司、杭州康恩贝制药有限公司、 烟台正方制药有限公司、江苏德源药业股份有限公司、重庆科瑞制药(集团)有限公司、北京太洋药业股份有限公司、成都迪康药业股份有限公司、上海朝晖药业有限公司、石药集团远大(大连)制药有限公司、杭州中美华东制药有限公司。其中上海凯宝、杭州康恩贝、江苏德源、北京太洋、华东制药均持有盐酸吡格列酮片30mg的批准文号。
公告显示,比利时的BAXTER S.A.企业申请注销了两个脂肪乳产品的批准文号,一个是脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液,规格为2000ml【脂肪乳注射液(10%)400ml;复方氨基酸(5.5%, 15AA)注射液800ml; 葡萄糖注射液(20%)800ml】,一个是脂肪乳(20%)/氨基酸(15)/葡萄糖(30%)注射液,规格为 2000ml【脂肪乳注射液(20%)400ml;复方氨基酸(8.5%, 15AA)注射液800ml;葡萄糖注射液(30%)800ml】。
中国健康传媒集团食品药品舆情监测系统显示,脂肪乳(10%)/氨基酸(15)/葡萄糖(20%)注射液是全球首个工业化“全合一”三腔袋产品,用于2岁以上的儿童和成人患者不能或功能不全或被禁忌经口/肠道摄取营养的营养支持。该产品的原研公司为百特,2013年获准在中国上市,商品名为克林维。目前,国内仅有四川科伦药业股份有限公司获得该产品的国产仿制药批文。而脂肪乳(20%)/氨基酸(15)/葡萄糖(30%)注射液还未有国产药品。
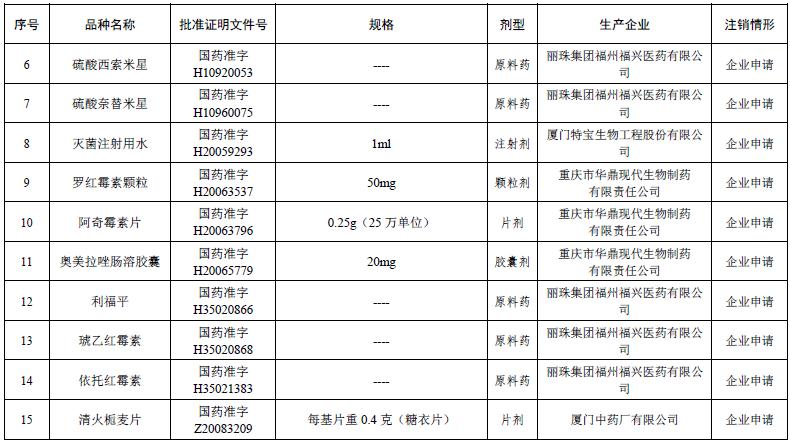
此外,根据公告,丽珠集团福州福兴医药有限公司申请注销了硫酸西索米星、硫酸奈替米星、利福平、琥乙红霉素、依托红霉素5种原料药的批准文号;重庆市华鼎现代生物制药有限责任公司申请注销了罗红霉素颗粒、阿奇霉素片、奥美拉唑肠溶胶囊三个批准文号;厦门中药厂有限公司申请注销了清火栀麦片的批准文号;厦门特宝生物工程有限公司申请注销了灭菌注射用水的批准文号。
注销药品批准文号目录
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:齐桂榕)
















