【“推进科学监管研究 引领产业创新发展”系列4】真实世界证据助推药械评价与监管决策
4月30日,国家药品监管局发布通知,决定开展药品、医疗器械、化妆品监管科学研究,启动实施中国药品监管科学行动计划,并确定首批九个重点研究项目,其中包括真实世界数据用于医疗器械临床评价的方法学研究等。近年来,真实世界数据与证据受到全球医疗卫生和监管决策部门的重视,尤其是药械监管决策的需求推动了真实世界证据的产生和使用。但在不同药械评价与监管决策环境下,对真实世界数据及证据的应用模式不同。本文探讨不同数据来源的真实世界证据在上市前药械评价、上市后药械监测与评价中的作用及其在监管决策中的价值,为正确生产和使用真实世界证据,推动药械监管决策提供参考。
药械监管是世界各国医疗卫生系统的主要工作之一。传统药械监管模式主要建立在以早期研究(如机理、药理、毒理等)、上市前传统临床试验、上市后监测和评价的系统性组织基础上。在过去几十年,该模式在保障药械有序研发、提高医疗健康水平、确保病患安全等方面发挥了重要作用。
随着疾病谱、医疗卫生和社会经济等各方面的发展,及创新体系进一步强化,传统药械监管体系面临重大挑战:一是如何实现创新医疗产品快速进入临床实践,在提升健康的同时,保证患者安全,尤其患者急需的创新医疗产品对现有监管模式的挑战更加突出;二是传统临床试验存在局限(如:纳入排除标准和干预措施与实际临床医疗存在差异、患者随访时间有限、难以观察罕见不良事件等),不能回答药械监管决策中的所有问题;三是上市后以不良反应自发报告为主的监测手段,在发现和证实药械安全性问题上存在局限。药械临床评价和监管模式迫切需要创新。
近年来,真实世界数据(real-world data,RWD)在全球范围日益受到医疗卫生和监管决策部门及临床实践者的重视。基于RWD产生的真实世界证据(real-world evidence,RWE)已用于医疗产品评价与监管、疾病管理、医保政策制定等多个领域。以美国食品药品管理局(FDA)为代表的全球药品监管机构对RWD的重视极大地推动了RWD及研究的快速发展。例如,FDA从2000年起,逐步建立了相关RWE体系用于药械审评和上市后监管,包括建立Sentinel系统,用于上市医疗产品安全监测与评价;发布RWE在药械监管中的多项规范,如《真实世界证据方案框架》《使用真实世界证据支持医疗器械监管》《使用电子医疗病历数据开展和报告药品安全性评价研究的规范》等。
RWD及研究在我国也日益受到关注。例如,国家药品不良反应监测中心2015年建立了中国医院药物警戒系统(CHPS),基于我国部分医院的电子病历数据主动发现药物安全信号;2018年10月,国家药品监管局药品审评中心基于RWE扩展了贝伐珠单抗的适应证,批准贝伐珠单抗联合以铂类为基础的化疗用于不可切除的晚期、转移性或复发性非鳞状细胞非小细胞肺癌患者的一线治疗。
推动上市前药械临床评价
RWE在药械上市前评价与监管中的应用还处于早期,如何基于不同类别RWD和不同研究设计得到的RWE来评估药械的临床价值并形成最终决策,仍处于探索阶段。但是,这些证据对医疗产品上市前、后监管决策的价值日益受到重视。RWE在药械上市前临床评价领域具有多方面的重要潜质。
一是通过调查治疗模式,寻找未满足的需求。RWE可探索真实诊疗环境中疾病流行病学特征,了解目标人群患者规模、疾病负担、临床特征和治疗模式,探寻实际诊疗中尚未被满足的医疗需求,为评估药械上市的临床价值提供重要证据。如基于医保数据库调查>65岁不适合华法林治疗的房颤患者抗凝药物治疗模式及患者依从性,这些实际诊疗中的患者特征、用药信息可为新药上市前准备提供重要参考。
二是能够辅助临床试验设计。RWE可用于辅助临床试验设计的多个方面,包括基于RWE形成的研究假设,可为进一步的临床试验提供假设依据;作为贝叶斯临床试验设计中的先验历史对照,为医疗器械临床试验提供先验信息;利用RWE明确潜在的研究人群,预先识别符合纳排标准的患者,辅助研究人群招募。
三是对已上市产品的新适应证或已有适应证进行修改。探索发现和证实药械在更多疾病领域的治疗价值(新适应证)是上市后药械评价的重要方向之一。美国《21世纪治愈法案》中明确规定RWE可作为已获批药物进行扩大适应证的证据来源。最近,基于美国电子健康记录、IQVIA保险数据库及乳腺癌数据库等RWE,FDA批准Ibrance(哌柏西利)新适应证的补充申请,联合一种芳香酶抑制剂或氟维司群用于治疗男性HR+、HER2-晚期或转移性乳腺癌。我国药品监管部门也基于RWE开展了有益探索,如基于RWE更新了贝伐珠单抗适应证。
四是进行国外已上市药械评价。对已在国外上市药械,特别是患者急需、无替代品种的药械,加快审批可促进新产品在我国的及早上市和患者可及。结合国际临床试验证据,利用真实世界临床数据进行产品评价并申请产品注册,可有效降低传统临床试验数据收集时间和经济成本。如以海南博鳌乐城国际医疗旅游先行区超级医院作为重要试点,进行真实世界临床数据的应用探索,加快医疗器械审批。
五是评价有条件上市药械。随着广大人民群众对药械需求日益加大,一些创新产品需要快速进入市场。我国药品监管部门近年来在药械评价及审批方面做出重大调整,减轻上市前临床评价负担、加快上市前审批速度、加强上市后研究。RWE在上市前评价和上市后研究方面均能发挥重要作用。
六是解决罕见病药品医疗器械上市前临床评价问题。罕见病药械研发受限于疾病发生率低、诊断不明确、无法满足传统上市前临床试验在设置对照、最低患者样本数等方面的要求,RWD具有覆盖人群广泛、研究周期短、对资源及成本要求相对较低等优势,可为开展罕见病药械上市前临床评价提供重要数据支持。
支撑上市后药械监测与评价
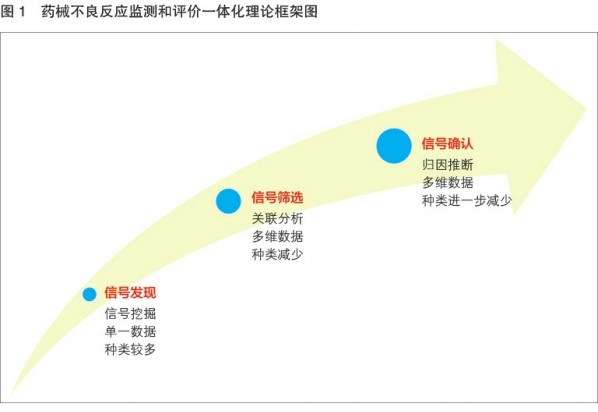
上市药械监测和评价的核心目的是通过不同数据资源和技术方法,发现、遴选并最终确认不良反应信号(见图1)。信号发现和筛选是上市药械监测的重要内容;信号确认是上市药械评价的最终目的。RWD及研究在上市药械监测和评价中作用至关重要,在现有药监系统已被广泛使用和重视。以美国哨点计划(sentinel program)为代表的上市医疗产品监测系统已成为该领域的标杆。
上市药械重点监测
在新药和新器械上市早期,监管部门及临床使用者对药械可能的危害,特别是罕见的、长期用药后发生的不良反应尚不明确。除需进一步验证上市前安全性信号外,及时发现新的不良反应信号是上市早期药械安全性监测的重要方面。
药品重点监测的关键目的是为进一步了解药品的临床使用和不良反应发生情况,研究不良反应的发生特征、严重程度、发生率等。但传统被动的监测方式无法提供不良反应发生率、发生特征等情况;新产品上市早期临床应用较少,样本量及结局事件数尚未得到充分累积,因此主动收集数据是主要工作方式。不良反应信号的关键来源是靠主动收集的药械登记研究实现,这种方式在很大程度上解决了新的医疗产品在上市早期因缺乏在实际目标人群中广泛使用而无法完成常规数据收集管理的困局。
上市药械常规监测
与重点监测不同,常规监测通过系统性、长期性收集所有上市药械不良反应信息,以达到对上市药械持续的安全性监测。其中,不良反应主动监测及被动监测系统是我国药械不良反应常规监测的重要手段,RWD可为药械不良信息从发现到确认的上市后监管决策提供重要的数据支撑。
被动监测通过收集自发报告系统的数据来收集药械不良反应的数据,早期发现药品不良反应信号,是目前我国药品不良反应监测的主要手段。但利用被动监测数据开展药品安全性评价存在固有局限性,包括漏报导致的不良反应发生率被低估、因填报信息缺乏准确性及完整性影响关联性评价结果等。而主动监测通过严格规范的实施过程,收集药品不良反应的相关信息,是不良反应信号发现和遴选的较好数据来源。2015年,国家药品不良反应监测中心发起了中国医院药物警戒系统(CHPS),该系统建立覆盖全国300家医疗机构的联盟哨点,通过与医院电子病历数据对接,可实现不良反应信号的主动识别,特别是院内的药物不良反应事件的识别。
上市药械的安全性评价
上市药械安全性评价的最终目的是需要明确早期发现的不良反应信号是否由使用的药械导致。要实现该目的,核心是通过严格的流行病学设计,在尽量减小偏倚、充分排除混杂的基础上,评估目标药械在与对照品相比的情况下,是否增加了相关不良事件的风险。
实现上市药械评价的手段之一是建立患者登记,在数据满足的情况下,既可用于信号发现和遴选,也可用于评价。如基于国家心血管经皮冠状动脉介入治疗(PCI)患者登记数据库纳入的73124例使用Mynx血管封堵器的患者,经倾向性评分匹配后分析显示:相比其他封堵器,Mynx血管封堵器会增加血管并发症、出血及输血的风险。
在上市后期,药械使用及相关结局数据在既有医疗数据库中得到累积,使评价这些累积数据成为可能。基于既有医疗管理数据库,可在短时间内获得暴露、结局及混杂变量相关信息,对成本及资源需求较少,这种模式成为评价成熟的上市药械产品的主要数据资源。如艾塞那肽上市后,FDA收到使用该药后发生急性胰腺炎的不良反应报告,使肠促胰素类药物是否增加胰腺炎风险受到广泛关注。针对监管机构重点关注问题,通过开展基于已有数据库的研究结果显示,肠促胰素类降糖药物并未增加胰腺炎风险。
促进RWE向药械监管决策转化
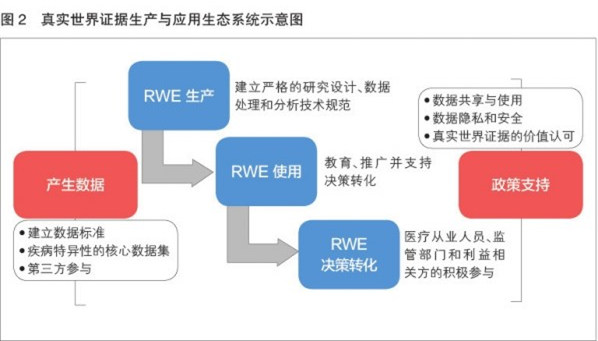
促进RWE向药械监管决策的转化,关键问题是要形成高质量数据和证据,核心是要有政策的支撑和认可。从数据到最终决策要经过许多环节,针对这些环节进行系统性设计,建立RWE的生产和使用的体系化、全链条生态系统(RWE ecosystem)是解决该问题的关键核心(见图2)。
为了推动建立我国RWE生态系统,2014年12月,中国循证医学中心牵头成立了国际药物经济学与结果研究协会(ISPOR)华西分会,以药品监管决策和重点疾病管理为目标,围绕RWD开展了合作研究与系列学术讨论会,并在国家药监部门的指导支持下,基于RWD开展了上市后药品安全性常规监测、高风险器械安全性信号挖掘、不良反应报告分析等探索。例如,基于医院电子病历数据库开展头孢哌酮舒巴坦致凝血功能异常或出血的安全性评价,为监管部门评价头孢哌酮的安全性提供重要的技术支持,今年3月,国家药品监管局已发布关于修订含头孢哌酮药品说明书的公告;针对高风险医疗器械,基于国家医疗器械不良事件报告数据,开展有源和无源医疗器械的安全性信号挖掘关键技术的开发与验证,形成基于现有国家医疗器械不良事件报告系统,系统开发和验证高风险医疗器械安全信号挖掘的方法模式等。
2017年10月,中国循证医学中心还牵头建立了中国真实世界数据与研究联盟(ChinaREAL),联合全国10余所权威高校中青年学术骨干及多个数据合作伙伴和专业学术杂志,开展方法学和实证研究,促进RWE的高质量生产、正确理解与合理使用。集成团队优势,构建RWD与研究技术体系整合药物流行病学、临床流行病学、医学统计学、医学信息学、循证医学、循证药学、临床医学、药物经济学等多学科优势,形成跨学科研究团队,构建了RWD与研究的系统化技术体系。涵盖RWD库构建、真实世界研究基本定义、分类、设计、分析和伦理审查,及其在药械评价中的应用。
【本文摘编自孙鑫 谭婧 王雯.等.真实世界证据助推药械评价与监管决策.中国循证医学杂志. 2019. 19(5):521-526.】

















