中国生物医药“新势力”崛起后,下一步怎么走?
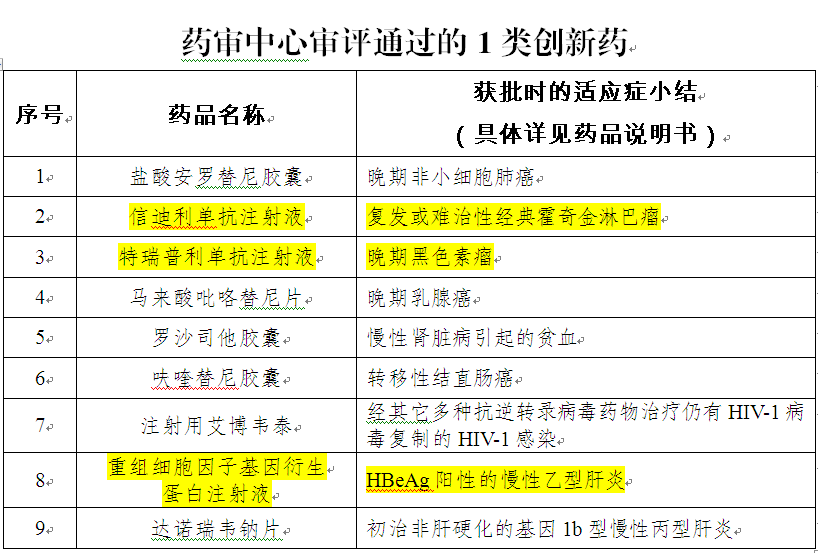
中国食品药品网讯(记者 落楠)国家药品监督管理局7月1日发布的《2018年度药品审评报告》显示,2018年国家药品监督管理局药品审评中心(以下简称药审中心)审评通过的九个1类创新药中,有三个是国产生物制品。中国自主研发的PD-1药物信迪利单抗注射液、特瑞普利单抗注射液和乙肝治疗药物重组细胞因子基因衍生蛋白注射液相继问世,标志着中国生物医药“新势力”正在崛起。
这些成果的取得,彰显着我国生物医药研发加速向世界前沿靠拢。《2018年度药品审评报告》显示,2018年,药审中心受理的需技术审评的5574件新注册申请中,815件为生物制品注册申请,较2017年增加了42%。另据药审中心药物临床试验登记与信息公示平台数据显示,截至2019年6月27日,平台登记的试验总数为11504项,其中17.37%为生物制品。作为全球生物制药赛道上的新力量,中国生物制药正在加速追赶。
创新研发开花结果
生物医药在解决临床未满足的需求方面具有独特的优势。近年来,全球生物医药产业快速发展,细胞治疗等新技术得到广泛应用,在肿瘤、免疫性疾病等疾病治疗领域呈现喜人进展。
我国生物医药研发正走入全球前沿领域,并取得可圈可点的成绩。2018年12月,两个国产PD-1抗体药物——特瑞普利单抗注射液和信迪利单抗注射液先后获批上市,与百时美施贵宝Opdivo、默沙东Keytruda一起满足国内患者需求;2019年2月,上海复宏汉霖生物技术股份有限公司(以下简称复宏汉霖)的利妥昔单抗注射液(汉利康)获批上市,中国首个生物类似药就此诞生;5月,苏州盛迪亚生物医药有限公司研发的注射用卡瑞利珠单抗获得上市批准,国产PD-1药物再添一员。
这些国产生物医药用于黑色素瘤、淋巴瘤等癌症的治疗,与进口药物形成竞争,促使后者降价,让中国患者能以更低的价格享受更多的治疗选择。
国产生物医药创新研发开花结果,预示着中国制药新篇章开启,其背后是国家的支持和企业的长期投入。我国政府高度重视生物医药产业发展,将生物医药列入《“十三五”国家战略性新兴产业发展规划》。国家药品监督管理部门先后出台《生物类似药研发与评价技术指导原则(试行)》《细胞治疗产品研究与评价技术指导原则(试行)》《生物制品批签发管理办法》等文件,促进并规范生物制药产业发展。
药审改革推出的种种措施,则让企业创新研发劲头更足。“评审的速度决定着研发成本和上市速度,最终会对企业药品的市场竞争产生重大影响。” 复宏汉霖联合创始人、总裁兼首席执行官刘世高说,自2015年起,通过调整审评审批程序、鼓励制药创新、国家药品监督管理部门加入国际人用药品注册技术协调会(ICH)、加快新药审评审批等一系列政策措施,中国医药行业加速与国际接轨,我国创新药物研发展现出新面貌。
《2018年度药品审评报告》直观地呈现了我国生物医药领域强大创新势头。2018年,药审中心受理1类创新药注册申请共264个品种(涉及533件受理号),其中1类生物制品(以药品通用名称计算)创新药注册申请106个品种(包括预防用生物制品6件,治疗用生物制品117件,共涉及123件受理号),较2017年增长了62%,其中,受理1类生物制品NDA 9个品种(包括预防用生物制品2件,治疗用生物制品9件,共涉及11件受理号),较2017年增长了4.5倍。
本土企业争相进入
医保支付对生物医药渐渐敞开怀抱。2017年通过价格谈判进入国家医保目录的36个药品中有12个生物医药。汉利康在获批1个多月之后便进入广西、上海等地的医保,速度之快出人意料。“伴随国家医保政策逐步跟进,重磅品种相继进入医保目录,国内抗体药物市场爆发在即。” 刘世高断言。
市场的激励让企业更有动力投身创新,本土企业蓄势张弓,抢滩生物医药研发,这在生物类似药领域表现得尤为突出。
科睿唯安 Cortellis数据库显示,从生物类似药的研发管线数量来看,中国以251个开发项目的绝对优势领先全球,这一数字是排名第二的欧盟的1.7倍。其中,处于临床阶段项目数为89个,处于临床前阶段的项目达117个。
“这说明我国生物类似药的发展势头良好,也显示出大量项目的开发重复。以阿达木单抗的生物类似药开发为例,29个活跃项目中,处于注册阶段的有4项、临床阶段的有7项、早期阶段的有18项。”科睿唯安生命科学与制药事业部首席科学家王刚博士分析。
企业仿制的终极目的应该是原研创新。“我们的产品开发策略是仿创结合,从生物类似药起步,逐步开发创新型单抗产品。”刘世高介绍说,截至目前,复宏汉霖13个产品、2个联合治疗方案已完成23项适应证的临床试验申请,覆盖乳腺癌、胃癌、肺癌、结直肠癌等多种肿瘤及自身免疫性疾病。
在王刚看来,生物医药领域的竞争将会日趋激烈,选好研发策略对企业至关重要。他说:“以生物类似药的研发为例,企业需要了解全国乃至全球的竞争格局,依据企业自身特点寻求项目差异化,而不应盲目扎堆开发热门产品。同时,要放眼国际市场,积极参与全球竞争。除了欧美主流市场,还可以关注对生物类似药接受度较高的新兴市场,如南美、中东和北非地区等。”
“这几年中国生物类似药发展虽然有些过剩,但反映了中国科研人员在早期研发和工艺研究上的实力。”杭州泰格医药科技股份有限公司高级副总裁陈文认为,中国抗体药物的崛起是依靠企业自身实力做起来的,药企人员有坚实的生物学基础和生产工艺开发经验,加上国内临床研究专家对本土创新药的鼎力支持,如果能在新的作用机制和靶点上做一些挑战性尝试,中国生物药在创新方面会有更多突破。
期待构建创新梯队
曾经有人提出,中国制药行业要赶上发达国家,“突破口”可能就是生物制药。
“我们确实看到了很多新成果,但我们也应该看到差距。”中国医药创新促进会秘书长冯岚说,中国生物制药将会实现从跟跑、并跑到领跑的转变,但是这个转变需要相对长的时间。
“需要时间,也需要配套政策尽快落地。”冯岚补充道,如专利链接、专利期补偿等政策影响着中国本土企业的创新和外国创新产品在中国的研发及上市,这是营造创新氛围、培育创新成果的重要条件。
冯岚也提出,中国要在生物制药领域赶超发达国家,需要培育创新梯队。“我们有一批本土研发企业在迅速成长,比如百济神州和信达。但是一个国家弯道超车愿望的实现不可能仅靠少数几家企业,应该培育出创新梯队,这需要国家政策的鼓励。”冯岚表示,某些医药政策需要在实践中适时调整,激发不同规模、不同类型企业的创新活力。
“我们的基础研究不够扎实。”中国医学科学院、北京协和医学院药物研究院副院长杜冠华直言,中国生物制药行业基础研究的短板亟待补上,要通过加强基础研究实现对生物医药有效物质的认识,提升创新能力,进而产出更多的创新药。“原来还有一些技术条件不足导致的落后。现在我认为技术条件不是制约因素,要想赶超发达国家,还是需要扎扎实实做研究,来发现真正新的、有效的药物。”杜冠华一再强调基础研究的重要性。
在刘世高看来,中国生物制药要实现“国产替代”并走向世界,制药企业必须有责任意识,产品质量必须和国际接轨。他说:“质量绝对不是侥幸的事情,生物制药遵循GMP规范进行生产和质量管理是一件需要长期坚持、积累和投入的事情。企业要坚守质量,从患者的需求出发,进行研发创新。”
王刚则认为,创新力的提升是一个系统工程,除了关注药物研发本身,我们还要对“配件”给予更多关注。“从生物类似药的工艺流程来看,我国在配套生产设备、原辅料、纯化设备、耗材等方面还大量依赖进口。”他提醒制药企业关注这些方面,国内相关企业也应加快研发进度,尽早完成国产替代,真正做到中国研发、中国生产,提高中国生物制药行业的综合竞争力。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:申杨)
















