一次性使用无菌中心静脉导管风险监测分析
中心静脉穿刺置入是危重病监护治疗中的基本技术,主要利用其测定各种生理学参数,同时也为各种治疗提供直接便利途径。大量静脉输液,肠外营养支持和临时心脏起搏等以上腔静脉应用最为广泛。中心静脉是指上腔静脉和下腔静脉,中心静脉穿刺置管是指任何一条静脉穿刺管使导管尖端到达中心静脉的方法。下腔静脉置管主要用于紧急抢救补液或特殊情况下的穿刺置管术。因其创口小,可将操作的医疗风险降到最低。
中心静脉导管采用的原材料必须是对人体无毒的,生物相容性符合《GB/T 16886 医疗器械生物学评价》相关标准。导管在人体留置时间在30天以内,产品需符合YY 0285.1-2017《血管内导管一次性使用无菌导管第1部分:通用要求》,YY 0285.3-2017《血管内导管一次性使用无菌导管第3部分:中心静脉导管》。其辅助穿刺配件需符合YY 0450.1-2003《一次性使用无菌血管内导管辅件第1部分:导引器械》,GB/T 18457-2015《制造医疗器械用不锈钢针管》等相关标准。
因此,在企业对于中心静脉导管的日常生产控制里,需要参考相关监管要求,结合产品风险,建立合适的风险监控点。结合产品具体工艺生产过程,对每一个过程和环节进行梳理,识别可能的风险,制定风险控制措施,开展控制措施的有效性验证,保障风险控制措施的有效性。
监测现状
参考《医疗器械监督管理条例》《医疗器械不良事件监测和再评价管理办法》《医疗器械召回管理办法》《医疗器械不良事件监测工作指南(试行)》等,并查询国家药品不良反应监测中心网站,中心静脉管暂未发现有不良事件。
风险点分析
在采购方面,材料本身的质量对于半成品、最终产品的性能有着至关重要的影响。不同物料种类对产品性能的影响程度不同,相同物料的不同性能(物理、化学、微生物等)也对产品性能的影响程度不同,基于此,对于物料的管理主要有以下方式。
第一,供方管理。建立供应商质量管理流程,建立材料质量标准,开展供方评价和物料材料评价工作,确保有资质有生产能力且生产质量稳定的供应商才被纳入合格供方清单内,减少供方供货能力导致的物料异常,进而对产品质量产生影响。
第二,原材料质量检验。建立质量检验和测试机制,包括测试设备、测试方法、测试人员等。建立原材料进货指导书,对材料质量进行检验,在流转到生产加工工序前,识别材料可能的异常,将风险控制在前端。
第三,对于一些高分子材料,原材料可能在存储过程中发生质量损失或质量失效的情况,需开展原材料有效期验证,确定原材料可以使用的时间。同样,对于一些可能受存储环境(如温度、湿度、光照等)影响的物料,需结合存储环境的研究,确定物料最佳存储环境要求,以防止不适当的存储造成物料质量下降或失效,进而影响产品质量。
生产管理方面,中心静脉导管生产经过管体挤出成型、接头注塑成型、打孔、装配等(详见图)。
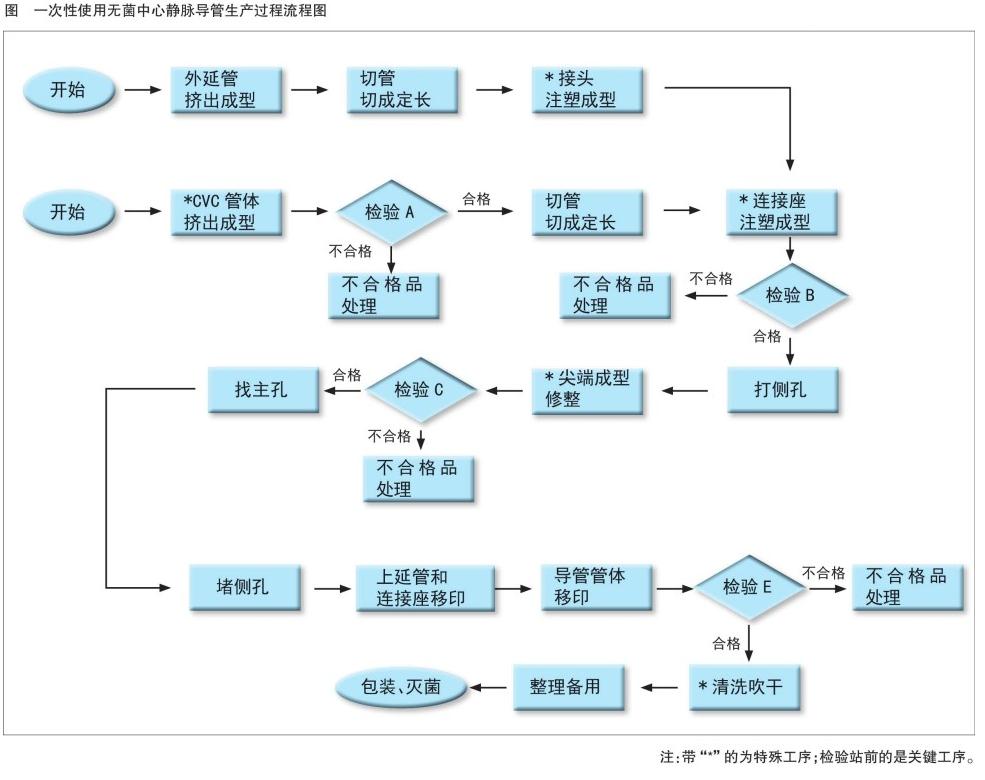
所谓关键工序是指对产品质量起决定性作用的工序。特殊过程是指对形成的产品是否合格不易或者不能经济地通过其后的监视和测量加以验证的过程。基于这个准则,我们不难发现,灭菌工序既是关键工序又是特殊工序。对于最终灭菌的医疗器械,无菌保证水平应当小于或等于10。影响环氧乙烷灭菌效果的因素主要包括温度、压力、湿度、环氧乙烷浓度、灭菌时间。
第一,灭菌温度主要与产品本身材料组件、物化性能、产品堆放状态、包装特性等有关。如灭菌温度既要在环氧乙烷本身的沸点以上,也不能超过产品本身的耐受温度,以免影响产品理化性能。一般情况下,常规极限通常在37℃~63℃,一般常用的合适温度为50℃±3℃。但是当温度高到足以使药物发挥最大作用时,再升高温度,则杀菌作用亦不再加强。
第二,灭菌过程中需要通过湿度的存在来膨润菌体,亲水性较好的环氧乙烷才能透过细胞壁或芽孢壁达到较好的灭菌效果,所以环氧乙烷气体灭菌时对湿度有要求。湿度底于30%时,不可能达到灭菌效果,即使延长灭菌时间也无效。通常要求在抽真空后、加药前进行灭菌,此时灭菌器内的湿度应控制在30%RH~80%RH范围内。
第三,压力的作用主要体现在真空度上,真空度的大小决定残留空气的多少,而残留空气可直接影响环氧乙烷气体、热量、湿气到达被灭菌物品的内部,所以灭菌过程尤其是加湿前真空度对灭菌效果影响巨大。真空度的设定主要考虑产品及包装的耐受范围,不能影响产品包装完整性。
第四,环氧乙烷的浓度一般在300~1000 mg/L,浓度过高可能会造成环氧乙烷残留较高,浓度过低,影响灭菌效果。
第五,灭菌时间的设定要求一般采用半周期法进行微生物性能验证,在除时间外所有其他过程参数不变的情况下,确定无存活菌的环氧乙烷最短有效作用时间(半周期)。灭菌工艺规定的作用时间应至少为半周期的2倍。灭菌时间短影响灭菌效果,但当灭菌时间(环氧乙烷暴露时间)延长时,可能影响产品的环氧乙烷残留及产品的生化性能。
因此,基于以上风险分析,对于一次性使用无菌中心静脉导管的环氧乙烷灭菌过程,需要基于环氧乙烷灭菌相关标准参考过程确认相关程序文件要求,对灭菌过程进行安装确认(IQ)、运行确认(OQ)和性能确认(PQ),确定灭菌工艺有效性,保障灭菌过程的可控性,确保灭菌后产品的性能满足要求。
针对确认通过的参数,形成可控的标准作业指导书和灭菌参数,确保产品灭菌过程按照标准化的方式进行,同时保留相应的过程记录,保障可追溯性。明确确保有培训上岗资质的生产员工操作相关事宜。
另外,当发生关键设备变更或有质量显著变化时,需要重新开展再确认工作。即使没有发生类似变化,也需要开展定期性的再确认(如年度性再确认),可通过重新确认或数据回顾等方式进行。
(作者单位:广东省药品监管局)

















