【“聚焦CAR-T治疗新动向”系列4】CAR-T靶点的全球研发格局
当前,全球范围内CAR-T疗法的临床试验数量正在大幅增加。
据美国癌症研究所(CRI)的统计数据,截至2018年2月,全球共有404项CAR-T项目正处于临床试验阶段。其中,美国有171项,中国有152项,中美两国的临床试验项目数占全球CAR-T疗法临床试验项目总数的79.95%,成为全球CAR-T细胞免疫疗法当之无愧的两大巨头。
CAR-T靶点分布
目前,全球临床在研的CAR-T项目涉及超过47个靶点,其中CD19、CD20、CD22、GPC3、BCMA等是热门靶点。从美国在研的CAR-T疗法靶点分布情况看,以CD19为靶点的临床试验项目占比超过40%,其次占比较多的是BCMA、CD22、CD30等靶点;我国以CD19为靶点的CAR-T临床试验占比也超过40%,但BCMA的临床试验数量不及CD20、CD22和GPC3,占比仅为5%。
从适应证上看,我国有75%的在研CAR-T项目拟用于白血病、淋巴瘤等血液肿瘤的治疗,仅有小部分在研项目针对肝癌、肺癌等实体肿瘤的治疗。
全球领先企业
在CAR-T疗法开发上,全球涌现出一大批领先企业。
诺华和Kite Pharma处于全球CAR-T研发第一梯队,分别于2017年上市了全球首个和第二个CAR-T产品,这在肿瘤免疫治疗上具有划时代的意义。2018年,这两家企业的CAR-T产品Kymriah 和Yescarta 分别在欧洲获批上市。目前,这两个产品正在其他适应证上开展临床试验,若进展顺利,预计未来5年,Kymriah 和Yescarta可获批治疗其他多种类型肿瘤。
Juno Therapeutics致力于肿瘤细胞免疫研究,是该领域的先驱公司之一,其JCAR015研发进度靠前,本有希望成为第一款获批的CAR-T产品。但由于二期临床试验被叫停,Juno于2017年3月正式宣布放弃JCAR015。尽管JCAR015出师未捷,但Juno的CAR-T研发管线十分丰富。同样以CD19为靶点治疗非霍奇金淋巴瘤的还有2个产品,分别是JCAR017和JCAR014,目前均处于临床一期研究阶段。此外,Juno还有多个以CD22、BCMA、WT1等为靶点的治疗多种血液肿瘤和实体瘤的在研产品。2018年1月,Celgene以90亿美元收购Juno,旨在共同打造广泛而新颖的细胞治疗产品组合。
Cellectis专注于开发基于基因编辑的同种异体CAR-T细胞疗法,即通用型CAR-T疗法(UCART)。目前该公司已经拥有3个获得美国FDA批准开展临床试验的同种异体、通用型、基因编辑CAR-T细胞候选产品(UCART19、UCART123和UCART22)。此外,另一款候选产品UCARTCS1正在开发用于治疗多发性骨髓瘤。
Bellicum是一家生物制药公司,专注于发现和发展针对肿瘤以及遗传性血液疾病的细胞免疫疗法,利用其独有的化学诱导二聚化技术
平台(CID)编辑和控制免疫系统的部分组分。Bellicum正在细胞治疗中的一些最重要领域,包括造血干细胞移植(HSCT)、CAR-T以及TCR细胞治疗,开发下一代候选产品。
中国研发进展
截至2018年8月,国家药品监管局药品审评中心(CDE)共收到26项CAR-T疗法新药临床试验研究申请(IND)。其中,南京传奇、恒润达生、药明巨诺关联公司明聚生物的IND申请已获通过,进入药品正式临床试验阶段。复星凯特、科济生物、精准生物等公司的IND申请还在审评中(见表)。
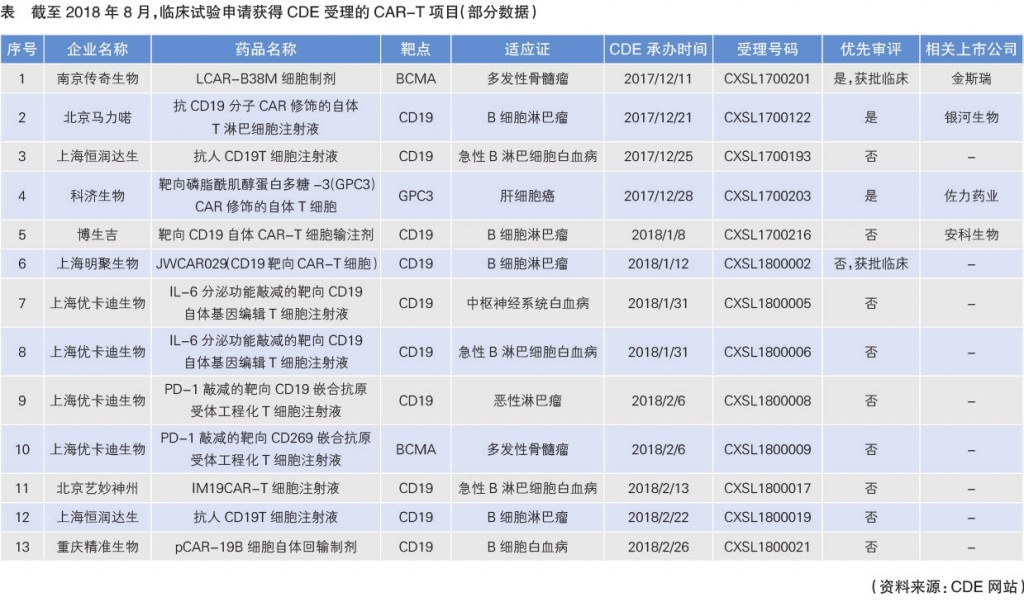
南京传奇生物科技有限公司是金斯瑞生物科技有限公司的全资子公司,该公司的LCAR-B38M是国内首个按“治疗用生物制品1类新药”申请获得CDE受理的CAR-T产品,随即获得了优先审评资格,并于2018年3月12日获批临床试验,成为国内首个按药物申报临床试验获批的CAR-T疗法。和众多公司扎堆研发CD19靶点不同,南京传奇生物另辟蹊径,选取BCMA为靶点治疗多发性骨髓瘤。此举一方面有利于进入优先审批流程,缩短审批时间;另一方面,可有效避开激烈的市场竞争,有利于抢占市场。
药明巨诺由药明康德集团和美国巨诺公司于2016年联合成立,旨在凭借双方优势联合打造中国领先的CAR-T公司,为血液肿瘤及实体瘤患者研发新型CAR-T疗法。药明巨诺的CAR-T产品JWCAR029的IND申请已获批准,成为国内首例以CD19为靶点的CAR-T临床试验。
2017年4月,复星医药与Kite Pharma在上海设立合资企业复星凯特,致力自主开发和转移世界最先进的细胞治疗技术,主要是对Kite Pharma已上市的CAR-T产品Yescarta和两个正处于临床前研发阶段的TCR产品(KITE-439及KITE-718)在中国进行技术落地、开发、生产并使其商业化。2018年5月,Yescarta用于复发难治性大B 细胞淋巴瘤治疗获CDE受理。复星凯特成功引进国外先进企业已上市的CAR-T产品,依托复星医药高度协同产品线和在国内的渗透能力,有助于Yescarta顺利登陆中国并打开市场。
科济生物作为一家专注于CAR-T免疫治疗的创新型企业,在研发团队、临床资源、技术实力及实体瘤靶向治疗等方面优势显著。该公司于2015年在上海交通大学医学院附属仁济医院开展了全球首个针对肝细胞癌的CAR-T细胞临床试验,以GPC3为靶标,2018年1月29日,该公司产品被纳入优先审评。
博雅控股集团是一家在生命健康领域具有广泛影响力的产业集团。旗下英科赛尔(IncoCell)研发了一条自动化、全封闭的临床级CAR-T细胞CMC生产线CAR-TXpress,该平台整合了多元化、自动化流程,包括T细胞的分离、纯化、培养、洗涤及单盒式自动冷冻保存(-196℃)和检索,能够实现免疫细胞手工分离流程自动化,实现规模化CMC自动化制备工艺,与现有技术相比具备卓越的性能和优势。
目前,国内CAR-T技术以临床研究为主,从现有数据看,虽然很多公司的单中心疗效数据较好,但整体上完全缓解率不如诺华、Kite等国际知名企业的产品,且目前开展的临床研究多为单中心研究,多中心临床研究联合仍然不多。与美国相比,中国大多数CAR-T企业依然在不断优化CAR-T基础构建和临床治疗流程,对于CAR-T技术的核心,如特异性CAR的筛选和构造等方面,中国企业参与度非常少。与此同时,基础研究进展上也有一定差距,目前公布的多项提高CAR-T安全性、有效性的治疗方式也多出自国外。CAR-T疗法为一项综合技术,包括细胞培养、基因编辑等技术,企业将其实现工业化生产需要病毒生产、细胞生产、产品研发等多专业人才。
此外,在产业化进程中,中国企业应该提高合作意识。目前国内几乎所有的CAR-T原创公司都是从质粒到载体再到CAR-T细胞全部自己生产,技术壁垒普遍不高,尽管各家公司的保密意识都很强,但像国外如Cellectics、ZioPharm、CRISPR Therapeutics等多家公司那样拥有自己突破性特色技术平台的格局还没有形成,对细胞治疗GMP生产中心设计、施工和验收的经验也都有限。

















