每周医药看点(6月16日—22日)
- 2025-06-26 15:33
- 作者:刘鹤
- 来源:中国食品药品网
中国食品药品网讯 国家药监局综合司就《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》公开征求意见;国家药监局药品审评中心(CDE)发布《中国新药注册临床试验进展年度报告(2024年)》……6月16日—22日,医药行业的这些动态值得关注。
行业政策及药监动态
1. 国家药监局综合司就《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》公开征求意见。征求意见稿总结优化创新药临床试验审评审批试点工作经验,提出了药物临床试验申请审评审批30日通道相关事项。征求意见截止日期为2025年7月16日。
2. 国家药监局决定,对相关斑蝥酸钠注射剂(包括斑蝥酸钠维生素B6注射液、斑蝥酸钠注射液、注射用去甲斑蝥酸钠、去甲斑蝥酸钠注射液、去甲斑蝥酸钠氯化钠注射液)说明书内容进行统一修订,修订内容涉及“不良反应”“禁忌”“药物相互作用”“药物过量”等项。
3. 国家药监局公布5起药品经营环节“清源”行动违法违规典型案例,包括广东省惠州市惠东县稔山镇燕记药店非法渠道购进药品案等。
4. CDE发布《中国新药注册临床试验进展年度报告(2024年)》。报告显示,2024年药物临床试验登记与信息公示平台登记临床试验总量达4900项(以临床试验登记号计),较2023年登记总量增长了13.9%。2024年登记的临床试验中,以境内申办者为主,占比为92.8%。
5. CDE发布《局部起效化学仿制药体外释放(IVRT)与体外透皮(IVPT)研究技术指导原则(试行)》,主要阐述化学仿制药IVRT与IVPT研究的方法开发、方法验证和实施的一般考虑和建议。
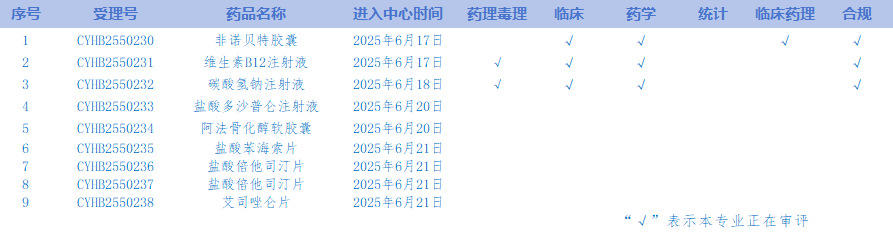
6. CDE网站公示9个仿制药质量和疗效一致性评价任务,涉及非诺贝特胶囊等品种。
产品研发上市信息
1. 国家药监局发布4期药品批准证明文件送达信息,共包括250个受理号,涉及山东京州药业有限公司等企业。
2. CDE承办受理43个新药上市申请,包括T3011疱疹病毒注射液等。
3. 上海医药宣布,公司下属上药泰国有限责任公司的普瑞巴林胶囊收到泰国食品药品监督管理局颁发的药品注册证书。普瑞巴林胶囊主要用于治疗带状疱疹后神经痛、糖尿病外周神经痛、纤维肌痛和脊髓损伤引起的神经性疼痛,以及癫痫的辅助治疗。
4. 百奥泰发布公告称,公司产品Usymro(乌司奴单抗注射液)获得欧洲药品管理局人用药品委员会(CHMP)积极意见。CHMP建议欧盟委员会(EC)批准Usymro上市,用于治疗中重度斑块状银屑病、活动性银屑病关节炎、中重度活动性克罗恩病。
医药企业观察
1. 复星医药与以色列Teva公司共同宣布,双方通过各自的子公司,就在研药物抗PD1-IL2 ATTENUKINETM疗法TEV-56278的开发达成战略合作。根据合作协议,复星医药将获得TEV-56278在中国以及特定东南亚国家和地区的独家开发、生产和商业化许可权。
2. 先声药业宣布,集团旗下先声再明与美国生物制药公司Next Cure,Inc.建立战略合作伙伴关系,将共同开发针对CDH6靶点的新型抗体偶联药物SIM0505,用于治疗实体瘤。
3. 沃森生物宣布与智峪生科达成合作,将共同探索人工智能技术在人用疫苗研发、生产及商业化中的应用,加速疫苗产业的技术创新与智能化进程。
4. 复宏汉霖宣布与上海市胸科医院签署战略合作协议。双方将在临床研究、人才培养和公益事业等领域展开深度合作。
药品集中采购
1. 四川省药械招标采购服务中心发布通知,公示部分药品降价情况,涉及浙江莎普爱思药业股份有限公司的醋酸钠林格注射液等产品。
2. 江苏省医保局就《关于完善药品挂网政策有关事项的通知(征求意见稿)》公开征求意见。根据该征求意见稿,江苏省将申报阳光挂网药品划分为创新药品、国家谈判药品及竞价准入药品、定点储备和短缺药品、集中带量采购中选药品等9类。 (刘鹤整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:周雨同)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐