GVP逐条谈 | 89.你真的会处理药品不良反应聚集性事件吗?
- 2021-09-28 08:51
- 作者:周格如
- 来源:中国食品药品网
【条文】
《药物警戒质量管理规范》 第六章 风险控制
第一节 风险控制措施
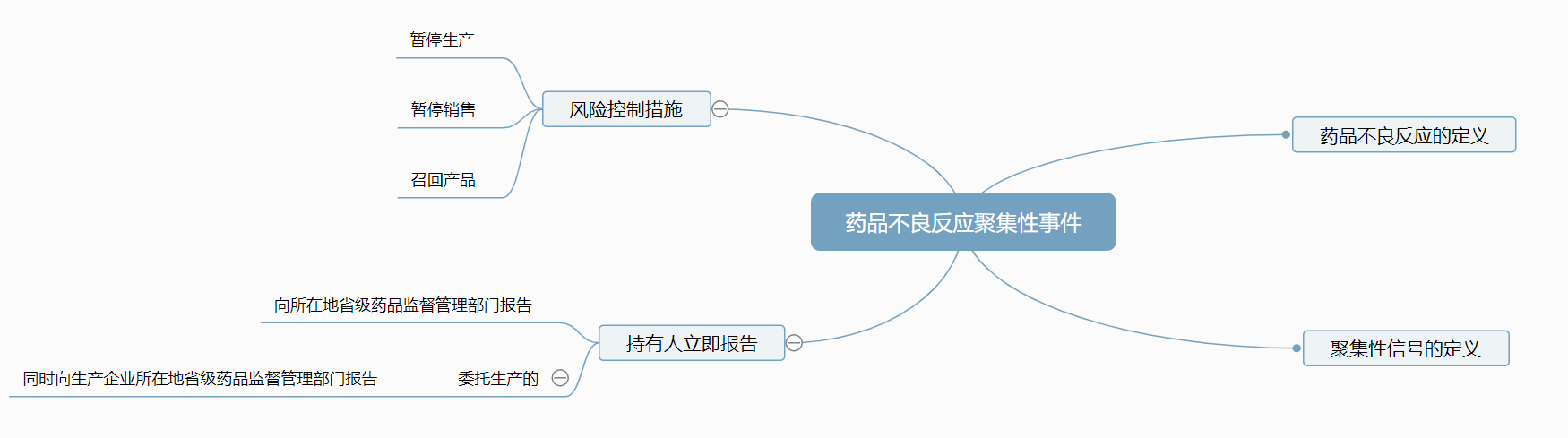
第八十九条 持有人发现或获知药品不良反应聚集性事件的,应当立即组织开展调查和处置,必要时应当采取有效的风险控制措施,并将相关情况向所在地省级药品监督管理部门报告。有重要进展应当跟踪报告,采取暂停生产、销售及召回产品等风险控制措施的应当立即报告。委托生产的,持有人应当同时向生产企业所在地省级药品监督管理部门报告。
【理解】
·聚集性信号的定义
关于聚集性信号,GVP与原国家食药监总局2016年印发的《药品不良事件聚集性信号监测处置工作程序(暂行)》中的定义一致,意为:同一企业同一批号或相邻批号的同一药品在短期内集中出现多例临床表现相似的药品不良事件,呈现聚集性特点。
聚集性事件是将药品不良反应的聚集性信号发展成为了确定的事件,可以结合起来理解。
·立即
“立即”一般理解为24小时内。即持有人在发现或获知药品不良反应聚集性事件的,应当24小时内组织开展调查和处置;采取暂停生产、销售及召回产品等风险控制措施的,应当在24小时内报告。
发生药品不良反应聚集事件立即开展调查和处置是将事件的危害性降到最低的必要性措施,同时应当尽可能地减少事件蔓延带来的影响,尽可能地避免其他更多潜在危险的发生,确保将患者的生命安全放在首要位置。
采取风险控制后应及时报告,使监管机构有效监督持有人的风险控制措施,并对事件的控制过程有全面、准确且及时的了解。
·风险控制措施
风险控制的四种基本方法是:风险回避、损失控制、风险转移和风险自留。
欧盟GVP“风险最小化措施”的定义为:为了预防或减少用药后发生的不良反应、减轻对患者的严重影响所采取的干预措施。
GVP第八十七条明确:常规风险控制措施包括修订药品说明书、标签、包装,改变药品包装规格,改变药品管理状态等。特殊风险控制措施包括开展医务人员和患者的沟通和教育、药品使用环节的限制、患者登记等。需要紧急控制的,可采取暂停药品生产、销售及召回产品等措施。当评估认为药品风险大于获益的,持有人应当主动申请注销药品注册证书。
《药品召回管理办法》第十六条明确:药品生产企业在作出药品召回决定后,应当制定召回计划并组织实施,一级召回在24小时内,二级召回在48小时内,三级召回在72小时内,通知到有关药品经营企业、使用单位停止销售和使用,同时向所在地省、自治区、直辖市药品监督管理部门报告。
【实践影响】
常规情况下的持有人需将相关情况向所在地省级药品监管部门报告;
委托生产的持有人应当(等同于必须)同时向双省级监管机构报告,即向所在地省级药品监管部门报告,以及生产企业所在地省级药品监管部门报告。
【延伸阅读】
GVP中药品不良反应聚集性事件与《药品不良反应报告和监测管理办法》中药品群体不良事件定义相比,其关注视角从患者生命安全损害前移至临床表现相似的疑似不良反应,使得临床用药风险的触发及预警水平更加敏感和精确,有利于风险的及时发现和处置,体现了以人民健康为中心的理念。
ICH指南E6:良好的临床实践(浙江太美医疗科技股份有限公司业务发展经理 周格如)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐
-

依案说法|关于一起无证生产出口化妆品案的定性
提供的信息及销售情况判断,当事人的行为属于无证生产出口化妆品。生产出口化妆品应遵守《化妆品监督管理条例》(以下简称《条例》),需要取得生产许可证,且化妆品必须检验合格后才可销售。辨... 2025-06-18 08:03 -

依案说法|以一起案件看“非法渠道购进药品”的判定
行政处罚案件的调查多为事后调查,往往难以还原事实真相,因此从提升行政效率的角度出发,对于本案中的情形可要求当事人主动提供证据,如合法的购进票据及资质证明材料等,以证明自身切实履行了... 2025-06-11 07:13
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有