数据|国内企业品种瘦身 跨国药企产品调整 从药品注册证书注销看产业变化
- 2021-06-07 11:12
- 作者:胡芳 辛悦然
- 来源:中国食品药品网
中国食品药品网讯(记者胡芳 实习记者辛悦然) 5月24日,国家药监局官网发布《关于注销醋酸甲地孕酮分散片等283个药品注册证书的公告(2021年第70号)》(以下简称《公告》)。《公告》显示,依据企业申请,国家药监局决定注销醋酸甲地孕酮分散片等283个药品注册证书。记者梳理发现,283个品种除了同质化严重的老普药,也包含部分跨国药企的明星产品。
不难看出,随着仿制药一致性评价推进、药审改革持续深入以及国家药品集中带量采购和使用常态化,国内企业对药品注册证书的认识更为理性,大量无意义的普药将随着药品注册证注销而消失;与此同时,跨国药企在华经营策略也悄然发生改变,更倾向于将新上市产品以及专利药引入中国,原研药则将陆续退出,以避开与中国仿制药的直面竞争。我国医药市场将进一步去赘肉、强筋骨,实现良性发展。
大量药品注册证“依申请注销”
根据《公告》,上述283个药品注册证书涉及28家企业。除了24家国内企业外,还有4家是跨国药企。
其中注销药品注册证书数量排名前十(含并列,共十二家)的企业分别为江苏晨牌药业集团股份有限公司、江苏大红鹰恒顺药业有限公司、海南全星制药有限公司、江苏正大丰海制药有限公司、金陵药业股份有限公司南京金陵制药厂、海南赛立克药业有限公司、南通久和药业有限公司、江苏金塔药业有限公司、江苏瑞年前进制药有限公司、海南双成药业股份有限公司、江苏亚邦爱普森药业有限公司、江苏亚邦强生药业有限公司(见表1)。
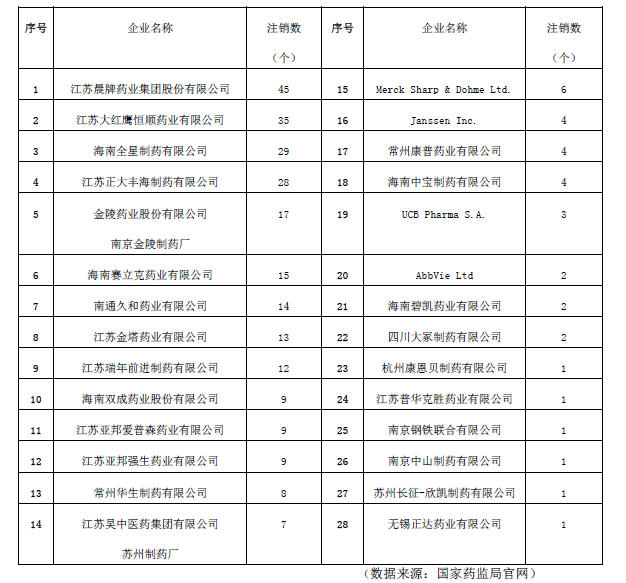
表1 企业注销药品注册证书情况统计表。
这也是自2020年9月以来,国家药监局第五次集中公告药品注册证书注销信息:
2020年9月8日,国家药监局公告注销注射用前列地尔等78个药品注册证书;2020年12月9日,国家药监局公告注销对乙酰氨基酚片等115个药品注册证书;2020年12月29日,国家药监局公告注销诺氟沙星胶囊等207个药品注册证书;2021年3月1日,国家药监局公告注销菠萝蛋白酶肠溶片等226个药品注册证书;2021年5月24日,国家药监局公告注销醋酸甲地孕酮分散片等283个药品注册证书。在这些被公告撤销药品注册证的,绝大多数为“依申请注销”,即企业主动申请注销。
相关人士表示,2020年是药品再注册的“大年”。根据《药品注册管理办法》,持有人应当在药品注册证书有效期届满前六个月申请再注册。“但一个注册证再注册的费用是近2万元,企业手上如果有几百个注册证,再注册费用就是几百万元。那么企业在进行再注册时,会结合企业发展,权衡成本与收益,主动放弃部分产品,向省级药监局申请注销注册证,省级药监局统一报给国家药监局,国家药监局汇总后集中公布。”
国内企业清理无效文号
药品的注册证书是药品的“准生证”。对于企业主动注销药品注册证,北京百思力营销策划有限公司创始人王恒认为,最直接原因就是这些药品对企业来说意义不大,有的是企业一直未生产(即业内所称“僵尸文号”),有的即使生产但不挣钱甚至是亏损品种,“在某种程度上实际是国内企业的一种‘断舍离’。”
从通用名来看,在《公告》注销的药品中,葡萄糖注射液、葡萄糖氯化钠注射液位居注销榜榜首,分别为12个、9个;此外乙酰螺旋霉素片、磷酸西格列汀片、安乃近片、甲硝唑氯化钠注射液、硫酸小诺霉素注射液、氯霉素片注销数均在5个及以上。
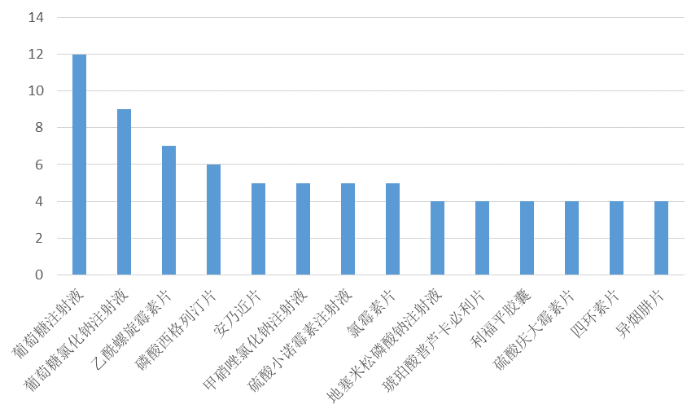
图1 申请注销药品许可证数量前十四(含并列)的药品名称。(数据来源:国家药监局官网)
查询国家药监局官网即可发现,此次《公告》注销的,绝大多数都是过度重复药品,如葡萄糖注射液、葡萄糖氯化钠注射液的现有注册证总数达3300个;乙酰螺旋霉素片的现有注册证数量为482个;安乃近片的现有注册证数量为844个;甲硝唑氯化钠注射液的现有注册证数量为228个;氯霉素片的现有注册证数量为354个;硫酸小诺霉素注射液现有注册证数量为138个……
品种高度同质化不仅意味着企业很难在市场中占到优势,同时意味着仿制药一致性评价压力巨大。
根据国家药监局相关公告,化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。而完成一个产品的仿制药一致性评价,大概需要500~1000万元。当企业没有能力完成一致性评价时,所能做的也只能是主动申请注销该品种的注册证。
一位业内人士也指出,多年以前,药品注册证私下交易屡禁不绝。但随着国家鼓励创新以及医保政策调整,尤其是在MAH制度下,药品上市许可转让呈现出新的特点,即充分考量其临床价值及稀缺性。这也使得企业手中大量普药的注册证书失去转让(买卖)的意义。
跨国药企调整经营策略
值得注意的是,此次《公告》中出现了跨国药企的明星产品,如艾伯维的奥比帕利片、达塞布韦钠片,默沙东的磷酸西格列汀片、优时比的左乙拉西坦片,杨森公司的琥珀酸普芦卡必利片等。
但这并不是跨国药企产品首次出现在国家药监局药品注销公告当中。据统计,从2020年9月至今,共有16家跨国药企主动注销了45个药品注册证书(见表2)。有业内人士认为,跨国药企主动注销药品注册证,传递出其在华经营策略的转变。
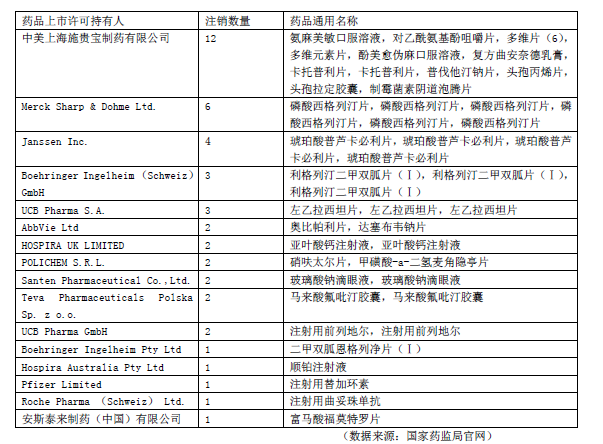
表2 跨国药企2020年9月~2021年5月注销药品情况。
资料显示,奥比帕利片联合达塞布韦钠片治疗方案于2017年9月20日首次在中国获批,2018年1月上市,用于治疗无肝硬化或伴代偿期肝硬化的基因1型慢性丙肝。记者注意到,奥比帕利片、达塞布韦钠片目前国内尚未有仿制药上市,意即艾伯维注销产品注册证后,这两个产品就此退出中国市场。对此,艾伯维相关人士表示,公司已于2019年已经上市了全基因型的丙肝治疗产品,此次注销的是第一代产品,只能用于基因1b型治疗,且申请注销是全球统一行动,“在中国,留下最好的就行了。”
对于默沙东来说,此次注销磷酸西格列汀片注册证书,则可能跟集采政策直接相关。磷酸西格列汀片是一款强效、高选择性的二肽基肽酶-4(DPP-4)抑制剂,用于改善2型糖尿病患者的血糖控制。目前该产品在国内销售超过10亿元。默沙东作为磷酸西格列汀片的原研厂家,此次注销了旗下涉及该产品的6个注册证。
记者在国家药监局官网查询发现,目前国内共有7个磷酸西格列汀片的注册证书,涉及浙江医药、广东东阳光、石药集团欧意药业、正大天晴4家公司,且这7个产品均通过了仿制药一致性评价。显然,磷酸西格列汀片已经具备进入集采的前提条件。这意味着一旦磷酸西格列汀片被纳入集采,默沙东就有可能面临着国内仿制药在价格上的拼杀。提前注销药品注册证,实则是选择了提前离场。
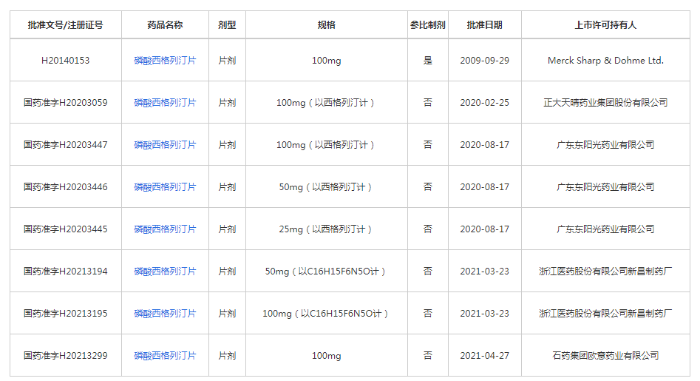
图2为磷酸西格列汀片通过仿制药一致性评价的目录。(数据来源:国家药监局官网)
有业内人士表示,跨国药企如果有产品集采中标,如果因为价格低等原因想要注销注册证,一般不被允许。近日,第五批集采目录公布,磷酸西格列汀片尚未被纳入。
此次杨森主动注销的琥珀酸普芦卡必利片是第三批集采品种,杨森的原研药并未中标(中选的企业分别为石家庄四药、江苏豪森药业、河北仁合益康药业)。公开资料显示,第三批集采后,杨森在多省撤销该产品挂网。
不难看出,随着我国仿制药一致性评价持续推进以及国家集采常态化,跨国药企会随之调整经营策略以及产品结构,过了专利期的原研药将逐步退出。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:宋佳薇)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-

-

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










