舆情看点|研发以患者为中心 中药创新药步入收获期 行业仍存难题待解
- 2023-06-21 16:22
- 作者:
- 来源:中国食品药品网

编者按
近年来,国家药监局全面落实《中共中央 国务院关于促进中医药传承创新发展的意见》,遵循中医药发展规律,传承精华、守正创新,持续推进中药审评审批机制改革,建立完善符合中药特点的注册管理制度和技术评价体系,以临床价值为导向,加快促进中药新药研制。2023年7月1日,《中药注册管理专门规定》将正式实施,进一步落实加快推进完善中医药理论、人用经验和临床试验相结合(以下简称“三结合”)的中药审评证据体系,体现中药注册管理的新理念和改革举措,并加强了对中药研制的指导。伴随审评审批制度不断深化,我国中药创新药产品迎来收获期,据不完全统计,2021年中药新药和创新中药获批数量首次突破两位数,2022年共有5款中药创新药获批上市,部分产品与企业受到社会关注。然而,中药创新药的发展也存在一些待解难题,如医疗机构制剂转化难、企业研发投入不高、中药产品出海难等问题,需要进一步关注、研究。
审评审批制度不断深化 中药创新药概念更加明确
2020年1月22日,国家药监局发布的新版《药品注册管理办法》(以下简称《办法》)中规定,中药注册按照中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药等进行分类。为配合《办法》实施,同年9月,国家药监局发布《中药注册分类及申报资料要求》,其中明确,中药创新药指处方未在国家药品标准、药品注册标准及国家中医药主管部门发布的《古代经典名方目录》中收载,具有临床价值,且未在境外上市的中药新处方制剂。一般包含以下情形:1.1类“中药复方制剂”,系指由多味饮片、提取物等在中医药理论指导下组方而成的制剂;1.2类“从单一植物、动物、矿物等物质中提取得到的提取物及其制剂”;1.3类“新药材及其制剂”,即未被国家药品标准、药品注册标准以及省、自治区、直辖市药材标准收载的药材及其制剂,以及具有上述标准药材的原动、植物新的药用部位及其制剂。
新注册分类中的中药创新药类别不完全等同于2007版《药品注册管理办法》中的第1、2、4、5、6.1类新药。原中药创新药是指未在国家药品标准、药品注册标准及国家中医药主管部门发布的《古代经典名方目录》中收载,具有临床价值,且未在境外上市的中药新处方制剂类别。新的中药创新药分类以突出疗效新为特色,重视临床价值评估,注重满足尚未满足的临床需求,并与以往仅要求在国内未上市的要求不同,应达到国内外均为新药的要求。
此外,国家药监局组织制定的《中药注册管理专门规定》(以下简称《规定》)将于2023年7月1日施行。《规定》进一步落实加快推进完善“三结合”的中药审评证据体系,体现中药注册管理的新理念和改革举措,并加强了对中药研制的指导,具有较强的落地实操性,为中药新药研发拓展新思路,将极大地激发中药新药研发的新活力。
产品跑出加速度 2021年获批中药创新药数量增长明显

图1 2017—2021年中药NDA(新药上市许可申请)、创新中药NDA建议批准量
(数据来源:《2021年度药品审评报告》)
伴随相关政策文件出台,制度不断深化完善,中药创新药获批数量交出满意答卷。如图1所示,2021年为近年来中药新药以及创新中药上市数量最多的一年,其中创新中药上市产品数量首次突破两位数,达到11件。如表1所示,据不完全统计,2022年共有5款中药创新药获批上市。除了已经获批的中药创新药,截至2023年6月12日,还有21款中药新药在审评中,其中1类创新药有11款,占比52.38%。

图2 2020—2022年获批中药创新药注册分类情况
(数据来源:国家药监局批准中药新药上市相关公告)
从注册分类来看,如图2所示,2020—2022年中药创新药中按照1.1类注册上市的产品最多,共8件,占比47.07%。原6.1类产品共3件,占比17.65%。1.2类、原5类、原6类各有2件,分别占比11.76%。

图3 2020—2022年获批中药创新药分类情况
(数据来源:药融云数据库)
如图3所示,2020—2022年获批的中药创新药中消化系统与代谢药物数量最多,共有4件,其中糖尿病创新中药2个,分别是芪蛭益肾胶囊和桑枝总生物碱片。此外,生殖泌尿系统药物、神经系统药物、肌肉-骨骼系统药物、呼吸系统药物各有3个。肿瘤药物为2022年1月20日通过优先审评审批程序附条件批准上市的淫羊藿素软胶囊。
中药创新药研发体现出以患者为中心、旨在解决临床未满足需求的趋势。例如,我国糖尿病患者数量居世界之首。2020年,桑枝总生物碱片获批上市,为近10年来首个抗糖尿病中药创新药。该中药新药上市,为2型糖尿病患者提供了一种新的治疗选择。在治疗痛风领域,公开数据显示,中国当前痛风患病人数估计已经超过1500万人,同时抗痛风药物在临床上的需求高速增长,2021年国内首个治疗痛风中药创新药虎贞清风胶囊获批上市,该药具有清热利湿、化瘀利浊、滋补肝肾的功效,适用于治疗轻中度急性痛风性关节炎中医辨证属湿热蕴结证,将为患者提供新的治疗选择。
此外,还有几项“首个”获批的中药创新药受到社会关注。2021年11月10日,江苏康缘药业股份有限公司的银翘清热片获批上市,这是自2020年7月1日新的中药注册分类实施以来,首个获批上市的1.1类中药,功能主治为辛凉解表、清热解毒,适用于治疗外感风热型普通感冒,症见发热、咽痛、恶风、鼻塞、流涕、头痛、全身酸痛、汗出、咳嗽、口干,舌红脉数。其获批上市为外感风热型普通感冒患者提供了一种新的治疗选择。2022年12月29日,新疆维吾尔自治区首个国家1类中药创新药“参葛补肾胶囊”获批上市。参葛补肾胶囊由新疆华春生物药业股份有限公司与清华大学生命科学学院联合自主研发,是治疗轻中度抑郁症的“十三五”国家重大新药创制·科技重大专项项目。该药由太子参、葛根和淫羊藿三味药材提取精制的有效部位群复合而成,是治疗轻中度抑郁症的创新中药。

图4 2020—2022年上市许可持有人获批中药创新药数量
(数据来源:国家药监局批准中药新药上市相关公告)
如图4所示,从企业角度来看,近3年来获批中药创新药数量最多的企业是石家庄以岭药业股份有限公司(以下简称以岭药业),共有3件。江苏康缘药业股份有限公司(以下简称康缘药业)紧随其后,共有2件。此外还有其他12家企业有1件药品上市。

图5 康缘药业、以岭药业2021年、2022年营业收入
(数据来源:企业2022年年报)
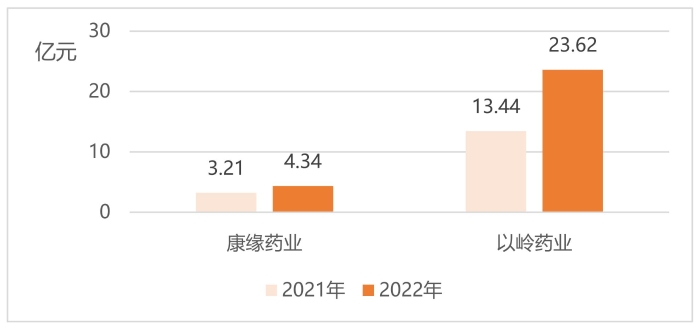
图6 康缘药业、以岭药业2021年、2022年归母净利润
(数据来源:企业2022年年报)
中药创新龙头企业康缘药业产品治疗领域覆盖呼吸、心脑、骨伤科、妇科等。2022年企业年报显示,公司有46个药品为中药独家品种,2022年共有2个中药新药上市,其中获批的苓桂术甘颗粒为首个按古代经典名方目录管理的中药复方制剂,是深入发掘中医药宝库精华、推进古代经典名方向现代药品转化的一次生动实践,实现了中药3.1类新药从无到有的跨越。如图5、图6所示,2022年企业营业收入、归母净利润均超两位数增长,其中2022年实现营业收入43.51亿元,同比上升19.25%。公司在稳定注射剂基础上,大力发展非注射剂品种,非注射剂品种全年销售收入达29亿元,占总收入的66.65%,同比增长23.69%,产品结构进一步优化。归母净利润方面,2022年公司净利润为4.34亿元,同比增长35.20%。
以岭药业围绕中药品种研发,公司聚焦于心脑血管、呼吸、精神、内分泌、泌尿、消化等核心治疗领域。现有研发管线覆盖在研中药创新药品种40余个,覆盖临床12个系统疾病,围绕已上市、研发不同阶段、筛选阶段进行研发阵列布局。2022年实现营业收入125.33亿元,同比增长23.88%。归母净利润23.62亿元,同比增长75.75%。
在研发投入方面,以岭药业2022年投入金额8.95亿元,同比增长6.87%,占营业收入的7.15%;康缘药业2022年投入金额6.21亿元,占营业收入比例的14.28%。两家企业从研发投入的绝对金额和营业收入占比两方面来看,均处于中药行业头部。
中药创新药“难”在哪儿? 医疗机构制剂转化“难”
医疗机构中药制剂具有较为丰富的人体使用经验、较为规范的制剂配制工艺和质量控制标准,在新药开发上具有独特的优势,是临床经验方与中药新药复方制剂之间的重要桥梁,但是医疗机构制剂的研发及使用过程中普遍存在临床定位宽泛、无法证明临床效果、临床数据量少、数据不完整或缺失、临床与成药性脱节等问题,导致人用经验的收集基础相对薄弱、用于支持中药新药研发的临床证据不足,成为现阶段制约医疗机构制剂向中药创新药转化的问题之一。南京中医药大学药学院、江苏省中药药效与安全性评价重点实验室、江苏省中医药防治肿瘤协同创新中心的韦忠红、陆茵撰写的《后疫情时代创新中药新药研发的策略与思考》一文中指出,医疗机构制剂的适应证宽泛、临床定位不明确,日服生药量较大、处方药味数较多、缺少法定药材标准或资源考虑不够、组方重复率大等因素,虽不是影响成药性的绝对原因,但会成为制约新药研发的困难点。缺乏有效性的分子机制科学研究的基础数据。其中,临床评价的不规范是阻碍医疗机构制剂向新药转化的最主要因素。此外还有知识产权保护、利益瓶颈、缺少良好的合作研发平台等问题。
中药企业“重销售、轻研发”
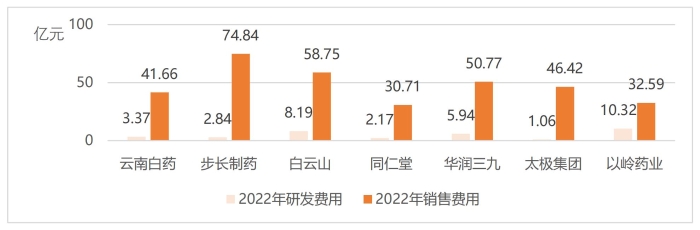
图7 2022年部分上市医药企业研发和销售费用情况
(数据来源:相关企业2022年年报)
产品销售费用过高,一定程度上反映出公司的研发能力不足,产品不具备核心竞争力。从长期发展来看,企业需要提高自主创新能力,优化产品结构,依靠产品提升行业竞争力。在众多中药上市企业中,2022年研发费用超过5亿元人民币的仅有5家企业,分别是以岭药业、天士力、白云山、康缘药业和华润三九。中药企业“重销售、轻研发”的现象普遍,如图7所示,部分中药领域头部企业研发费用不及销售费用的10%,国内中药企业关注终端市场,重视营销渠道,但往往忽视了产品研发重要性。
百家号“北京商报”发布《研发强度低于行业平均水平,中药革新仍待突破》称,由于中药新药研发长期套用化药标准,导致中药新药申请难度较大,中药企业研发积极性不高。近年来,随着中药研发政策体系不断完善,中药企业研发投入持续加大,但研发强度(2022年前三季度为2.55%)仍低于医药行业平均水平(3.71%)。
微信公众号“OMAHA联盟”发布《我国中药新药研发现状》称,虽然中药企的整体研发投入费用有所提升,但结合数据来看,2022年上半年也只有14家上市药企研发投入比超5%,相较于多数投入比都在10%以上的化药生药药企来说,研发投入仍有待提高。
中药产品出海“难”
中医药在全球疫情防控中发挥了不可或缺的作用,此次的疫情向全球展现了中医药的特色与优势,为中医药走出国门、走向世界提供了一个很好的契机。但是目前中成药在美国市场仍未实现零的突破,与化学药品相比,中药的物质基础及药理机制更为复杂,有效性等方面的评估需要依托于严格的循证评价。但循证医学证据困境恰恰与中医药理论体系不符也是中医药国际化的“瓶颈”所在。
微信公众号“米内网”发表《中药1类新药井喷!中药新药研发的痛点与要点有哪些?》称,中医药要想真正实现国际化,关键还是要以中医临床优势病种为目标,研发符合国际注册标准规范的药品来破冰欧美等主流市场。按照FDA的《植物药指南》,中成药可以经进一步研究成为植物药。虽然FDA先后出台不少政策支持植物药进入美国市场,但其在含多成分的植物药的审评审批仍旧非常谨慎。FDA在对植物药的审评审批上,非常注重质量,包括生产体系、种植体系等,临床上先关注安全性再关注有效性。植物药成分多且复杂、有效成分无明确定义、成分容易发生变化等,在质量、安全性、有效性等标准上难以明确,这给FDA的审评审批带来很大的挑战。如果在临床开发过程中,植物药的物质或产品发生变化,可能需要进行非临床桥接研究。
微信公众号“药智网”发布《中药创新药Biotech,“倒”在黎明前》称,为了能够让中医药获得国际认可,中药创新药必须参照甚至沿用西医西药研发中的提取工艺、质量标准、药理试验、临床试验等实质性研究的内容和方法,用现代科技手段阐明中医药理论,证明产品临床疗效和安全性。
点评
从近年来中药新药及中药创新药在评以及获批数量来看,目前中药创新药发展势头良好,已经步入收获期。随着《规定》的发布实施,将进一步落实加快推进完善“三结合”的中药审评证据体系,体现中药注册管理的新理念和改革举措,加强对中药研制的指导,激发中药创新的新活力。总体来看,中医药行业持续迎来政策利好,但中药创新药也同样面临一些挑战和问题,未来相关部门和企业在深化行业改革、优化行业结构、规范行业健康发展的同时,也应传承、创新并举促进中医药高质量发展。(内容由中国健康传媒集团舆情监测中心提供)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-

-
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










