促进制剂研发高质量发展 加快中药新药上市进程——现阶段古代经典名方中药复方制剂研制过程常见问题及解决办法探析
- 2023-07-17 09:03
- 作者:刘艳 章军 师玉华 邸继鹏 仝燕 刘安
- 来源:中国医药报
为传承发展中医药事业,加强古代经典名方中药复方制剂的质量管理,我国先后出台了一系列政策文件(详见表),鼓励开展研制古代经典名方中药复方制剂。这些文件解决了前期研发过程中存在的一些共性问题,比如注册分类、基原、剂量折算等。
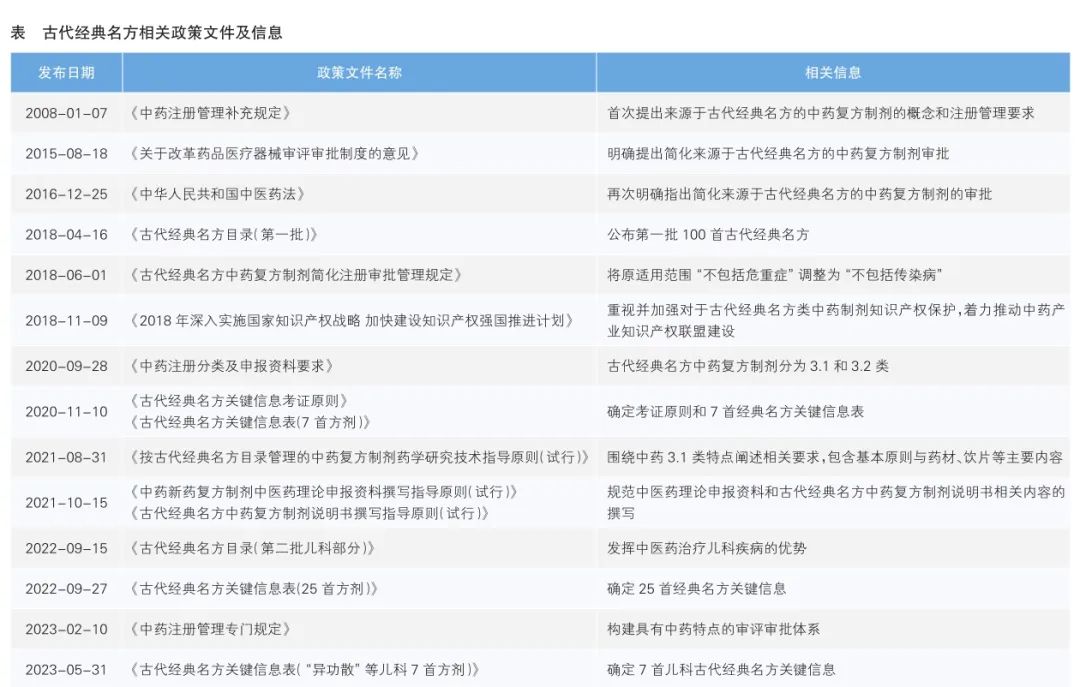
然而,进入研制阶段后,一些常见的现实性问题开始出现,如市场上药材基原混杂、质量波动大,饮片炮制不规范,制剂工艺转化困难,制剂生产难达物质基准要求等。目前,对于如何处理和解决这些问题尚未达成共识,这也成为当前古代经典名方中药复方制剂开发领域亟需重点关注的内容。
药材基原鉴别问题
基原考证和鉴别是保证古代经典名方临床使用有效性和安全性的关键。2020 年 9 月国家药监局发布的《中药注册分类及申报资料要求》指出,“多基原的药材除必须符合质量标准的要求外,必须固定基原,并提供基原选用的依据”。中药材基原考证是在厘清历代药材基原变迁情况的基础上,结合当前药材的资源情况,综合古籍记载、历史变迁等多方面因素加以详细考证,重视主流品种,从而选定基原。目前国家发布的39首经典名方关键信息表涵盖91种药味(30种多基原),可作为重要的参考依据。而基原考证后的基原鉴别是当前实际研发中面临的更重要问题,主要有以下三种情况需要具体分析解决。
一是《中华人民共和国药典》(以下简称《中国药典》)(2020年版一部)收录的是单基原药味,关键信息表考证与其一致。此种药味数量在已确定的91种药味中占比约67%,即从古至今该药材基原无变迁,容易采购15批以上药材,但同时仍需关注是否存在混伪品、农残是否超标、含量是否合格等问题。
二是《中国药典》(2020年版一部)收录的是多基原药味,而关键信息表考证为固定某单一基原。该类药味数量在已确定的91种药味中约占19%,可通过植物分类、生药鉴定及DNA条形码等分子鉴定方法区分药材基原;但因市场供求失衡,混种严重,可能短时间内难以保障单基原采购需求。以甘草为例,已发布的39首古代经典名方的关键信息表中有26首方剂涉及甘草,考证皆为豆科植物甘草。然而,市场上同时存在胀果甘草和光果甘草,或杂合存在,此种情况可能导致乌拉尔甘草供不应求,而其他两种基原甘草却无人问津。此外,对于地骨皮,由于关键信息表中其被考证为茄科植物枸杞,但市场上宁夏枸杞基原的地骨皮流通较多,笔者团队曾在安徽亳州药材市场随机购买了11批,采用DNA条形码鉴定发现有7批是宁夏枸杞。由此可见,企业可能需多次采购方可满足15批以上皆为关键信息表中要求的单基原。同时,建议药材供应商或者相应机构建立共享平台,及时分享固定基原药材的供求情况。对于历史上采用多基原的药味,建议考证信息只给出其包含的范围,由企业根据实际情况选择合适的基原。
对于化学成分含量差异较大的多基原药材,如肉苁蓉和管花肉苁蓉,进行单基原投料较为合理。而还有一些多基原药材,其化学成分含量差异较小,与《中国药典》标准一致,则需要考虑进行单基原投料是否能够保障产品质量的稳定性;药材质量的批间差异和品种差异究竟哪个是更大的影响因素;传统上,古代经典名方多是采用混合基原投料,如今要求单基原投料是否有助于提高疗效等问题。针对这些问题,还需要进行更多深入研究和探讨。
三是《中国药典》(2020年版一部)收录的是多基原药味,关键信息表中与其一致,但《中国植物志》已将多基原进行了合并,或者很难鉴别出多基原物种之间的差异。该类药味数量在已确定的91种药味中约占14%,主要存在两种情形:一种如黄芪,《中国药典》(2020年版一部)收载了中药黄芪的两种基原,《中国植物志》英文修订版已将蒙古黄芪、膜荚黄芪合并统称为蒙古黄芪,虽然目前已有文献报道这两种基原有基因位点区别,但由于市场上鱼龙混杂,区分后收集难度较大,因此建议按照《中国药典中药材DNA条形码标准序列》及中药材DNA条形码鉴定系统的有关内容,将两种基原合并统称为蒙古黄芪,不作区分;另外一种如蔓荆,《中国药典》(2020年版一部)收载的蔓荆为马鞭草科植物单叶蔓荆或三叶蔓荆,前者是后者的变种,基于现有的分子鉴定方法,尚无能够区分二者的相关研究报道。根据《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》要求,针对这类药材如果确需使用多基原,则要固定多基原使用比例。为了满足该要求,不建议直接从市场收集药材,而是使用可追溯的来源于GAP(《中药材生产质量管理规范》)基地的药材,深入进行药材基原鉴定研究。但从现实操作角度来看,固定多基原比例非常困难,且监管难度也较大,期待各方后期通过沟通交流的方式找到更加合适的处理措施。
药材质量波动问题
中药材属于农产品范畴,不少中药材栽培技术尚不成熟,加之受外界环境等因素的影响,其产品质量波动较大。通过控制饮片质量的一致性,能够保障中成药产品质量的一致性。那么,为了保障产品的一致性,是否可以在物质基准研究时只收集含量为30%的药材?答案显然是不可以,因为这样的药材不具有代表性。物质基准研究的目的是反映临床用药实际状况;再根据临床用药实际状况,选取合适的含量范围。从药材到物质基准制备需要经过炮制和提取两个工艺流程,误差在30%的药材亦不能保证物质基准的含量也在30%左右。因此,物质基准研究应该采用具有广泛代表性的药材,经过炮制、提取、干燥等工艺流程获得的物质基准,其含量范围为平均值的上下30%。为了保障药品制剂阶段的质量均一、稳定,需要通过均一化方法控制饮片质量,同时需要对生产过程进行控制。因此,物质基准研究阶段和制剂生产阶段对饮片的质量要求不一致,在古代经典名方开发过程中应该注意二者的区别。
另外,对于国家药品标准中无含测项要求的中药材原料,为了更好地控制其标准汤剂的质量,有时需要建立其含量标准。这种情况会导致符合《中国药典》标准的饮片可能不符合物质基准研究的需要。例如,笔者团队曾收集不同产地的43批桑白皮,检测其桑白皮苷含量为0.005%~3.829% (差异超700倍)。为了保证所使用的药材制剂质量稳定,笔者团队在《中国药典》(2020年版一部)标准的基础上,参考国家药品标准YBZ-PFKL-2021106《桑白皮配方颗粒》 制定了更为完善的桑白皮药材内控标准,包括设定桑白皮苷含量不得少于0.56%等,最终确定19批桑白皮用于古代经典名方基准样品的研究。
饮片炮制规范问题
中药炮制有着上千年的历史。随着时代发展,炮制方法亦在不断变化,出现了同名异义或异名同义的情况;同一药材在不同地区也有不同制法。复杂多样的炮制方法及久远的历史变迁,造成炮制品种间的混乱,而炮制方法的考证是解决这些问题的根本方法。对于《古代经典名方目录(第一批)》(以下简称《目录》)中方剂涉及的药味,大多未明确记载药材的具体炮制工艺,较少规定炮制程度,这导致古代经典名方中药复方制剂开发人员常面临炮制程度判断依据、炮制专用设备使用方面的问题。
在炮制程度判断依据方面,以“炒”为例,“炒黄”和“炒香”都是感官词,在具体操作时,若仅将“黄”或“香”作为终点判断,由于不同操作人员判定程度有差别,往往导致“炒”同批药材质量差异明显。以甘草为例,《中国药典》(2020年版)中清“炒”法为“将甘草药材除去杂质,洗净,润透,切厚片,炒至微黄”,而《浙江省中药炮制规范》(2005年版)收载的“炒甘草”为“取甘草(厚片),炒至表面深黄色,微具焦斑,取出,摊凉”。两种标准中规定的“炒”的程度不同,应按照关键信息表的要求“炒至微黄”,同时进行炮制工艺研究,即针对炮制设备温度、药材表面温度和炒制时间等参数对关键质量属性(如指标成分、出膏率、水分等)的影响进行系统性研究。
另外,《目录》中还有部分药材的炮制涉及专用设备使用,如“地骨皮(焙)”,目前尚未有专用于“焙”的设备,建议可用“炒”锅替代以确定相关参数。“焙”和“炒”的差别在于温度高低和是否翻炒,相较而言,“焙”的温度设置更低,以80~100℃为宜,且“焙”的过程中一般不翻炒。
基准样品质控问题
基准样品的质量研究与后续的制剂研究密切相关。《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》要求,“原则上处方中各药味应在制剂质量控制项目中体现”和“浸出物/总固体、含量测定等项目应确定上下限”。在实现上述目标的过程中,古代经典名方中药复方制剂开发的质量标准研究阶段常出现以下两种情形需要处理。
一是含挥发油类中药在质量控制项目中体现方式的选择。含挥发油的常用中药有薄荷、干/生姜、莪术、艾叶和肉桂等。挥发油类成分在煎煮过程中由饮片转移到汤剂中,随着汤剂的蒸发,挥发油类成分会有部分损失。如果采用冻干或者减压干燥的干燥形式,多数挥发油会全部消失。因此,建立汤剂中挥发油类成分的检测方法,研究其动态变化过程,可为合理制定物质基准中挥发油的限量标准奠定基础。以干/生姜为例,《目录》中含“姜”的古代经典名方有46首,用量从1片到6两不等,因而将挥发油成分作为定量、定性指标还是不予关注取决于其含量的多少。建议对于挥发油含量占总提取物0.05%以上的,在制剂生产时需要单独提取挥发油,将其作为定量指标;对于含量占0.01%~0.05%的,可将其作为定性指标,在制剂生产时不需要单独提取挥发油;对于含量占0.01%以下的,可以不予关注。对于含有挥发油含量较高的药材的古代经典名方,将其开发为合剂可能比颗粒剂更为合适。
二是基准样品质量属性指标上下限的确定。质量属性指标的确定一般以15批以上基准样品数据平均值的±30%作为确定上下限浮动的依据,实际操作中可能会受原料药味质量的影响或限制。如原料药味批次收集产地和时间过于集中,其批次间质量差异范围较小,导致建立的基准样品质量属性波动范围较窄,不具有代表性;或在国家药品标准中缺乏原料药味定量指标,导致收集的药材虽“合格”但不“优质”,甚至不能满足后续制备生产的要求。因此,建议原料药味收集一定要具有广泛性,且应在建立内控标准的基础上再进行收集。
制剂工艺转化问题
古代经典名方中药复方制剂生产工艺以达到与基准样品“质量一致”为目标。其中,前期主要研究指标成分从饮片到汤剂和物质基准过程中的成分转移规律,明确提取过程、温度、时间、浓缩过程、过滤过程、干燥过程等对指标成分的影响;后期以一致性评价为指导,优化产业放大工艺。然而,实际生产中常常会出现一些特殊工艺难以转化的情况,如针对煎药工艺(先煎后下、包煎和蒸兑)、煮散、生产过程成分变化(如挥发油成分变化)等问题,皆需酌情处理。
对于特殊煎药工艺转化问题,由于工业生产难以实现先煎后下的过程,而“包煎”则可以实现,但又增加了生产成本,为实现制剂工艺的转化,需要先研究这些工艺的科学内涵。例如,采用“先煎”工艺的原因主要有两种:增强疗效、降低毒性。采用“先煎”工艺的药材主要有两类:质地坚硬的矿石、甲壳类;含毒性成分的植物类中药,如附子、乌头等。采用“后下”工艺的原因是为了减少挥发油的损耗,使有效成分免于分解破坏。采用“后下”工艺的药材也主要有两类:包括有效成分受热易挥发的中药,如薄荷、砂仁、青蒿等;有效成分受热后不稳定的中药,如大黄、番泻叶、(生)苦杏仁等。采用“包煎”工艺的药物主要是一些种子类药物或者粉状药物,由于其粒径十分细小, 煎后不易过滤,遇水后又可变黏,容易糊锅,通常将这类药物用布包起来再煎煮。“蒸兑”工艺主要用于一切胶质类中药,如阿胶、鹿角胶等需要单独蒸后再与其他中药兑冲服。因此,建议在充分了解处方中特殊煎煮方式的内涵及具体药味情况后,通过调整饮片规格(如增加前处理)、并联提取等方法,建立适用于工业化生产的工艺,不必拘泥于基准样品阶段使用的“煎药工艺”,可适当增加或减少工艺步骤。
对于煮散工艺转化问题,与普通中药饮片汤剂相比,采用煮散工艺时基准样品制备阶段的料液体积比较大,有效成分煎出量和干膏率均较高,建立的基准样品质量属性指标,即平均值及转移率均较高。而在工业生产中,提取溶剂和投料比一般为8~12倍,且分离、浓缩、干燥和制剂成型过程都会有份量损失,而生产使用的原料份量又偏低,极易造成无法满足基准样品“一致性”要求的情况。建议研究工业化生产中搅拌操作和粒径大小对煮散工艺的影响,再次明确合适的煮散粒径和搅拌方式,探讨离心、板框过滤、膜过滤等过滤方式对产品的影响,形成适用于工业化生产的煮散工艺。
对于生产过程中的成分变化问题,以含挥发油类成分的处方制剂为例,需要考虑以下几种情形:挥发性成分与制剂功能主治相关性,含挥发油成分的“后下”药味,基准样品(煎液)中的挥发性成分情况,制备工艺和生产设备的匹配性,剂型选择的合适性等。在制剂阶段,针对这类处方可以通过采用水蒸气蒸馏法对基准样品(标准汤剂)和混合药材进行芳香水或挥发油模拟提取,并对比其指纹图谱,若未发现有重叠峰,则证明基准样品(标准汤剂)中不含或含较少挥发油,制剂工艺流程可不考虑挥发油,则可制备成颗粒剂;若发现有重叠峰,建议在制剂煎煮时增加挥发性成分收集步骤,最后通过挥发性包合物制成颗粒剂,或提供支撑数据证明该处方不适合制成固体制剂,向有关部门申请改剂型为合剂。
制剂与物质基准一致性评价判断问题
判断制剂和物质基准一致性多采用定性和定量两种方法。其中,定性以指纹/特征图谱为主,定量以含量变化作为依据。若指纹图谱相似度在90%以上,一般视为产品的相似度较好。然而,这种相似度评价多用于评价不同来源的药材、饮片或中成药。对于采用同一批次原料、相同溶剂、不同提取工艺制备的产品,以相似度90%作为一致性评价指标的标准可能过低。因而,对于采用同一批次原料生产的制剂和物质基准,采用指纹图谱相似度90%作为一致性判断依据,可能标准过低。在这种情况下,采用相似度95%可能更为合适。对于基于定量方法的一致性判断,定量指标差异不宜超过10%,最好在5%以内。(刘艳 章军 师玉华 邸继鹏 仝燕 刘安)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:常靖婕)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-

中国医药报社2025年“新春走基层”工作获表彰 一人获评全国性行业类媒体优秀个人
4月25日,中国行业报协会公布了2025年“新春走基层”活动优秀报道团队、优秀个人和优秀作品的获奖名单。 2025-04-28 10:14 -

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










