国家药品抽检年报(2023)
- 2024-03-26 16:26
- 作者:
- 来源:中国食品药品检定研究院网站
2023年是全面贯彻党的二十大精神的开局之年,也是实施“十四五”规划承上启下的关键之年,国家药监局认真贯彻习近平总书记关于药品监管工作的重要指示批示精神,坚决贯彻党中央、国务院决策部署,服务国家重大医药政策执行,紧紧围绕药品监管实际需求及药品生产经营结构的动态变化,聚焦监管重大战略、重点品种、重点环节,精心组织实施药品抽检工作,持续筑牢药品安全底线,提升药品监管效能,组织各省(自治区、直辖市)药品监管部门与相关检验机构,在全国范围内对部分生产、经营、使用等环节的药品质量开展抽查检验工作,评估上市后药品的质量状况,打击制售假劣药品行为。通过持续完善药品抽检管理体系,不断创新监管的制度机制和方式方法, 协同高效做好新形势下的药品抽检工作。2023年国家药品抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。
一、概述
药品抽检作为药品上市后监管的重要手段之一,是实现风险管理、科学管理、监管前置的重要技术支撑。多年来,在打击违法违规、震慑不法企业、评价药品质量状况、提升行业标准、警示公众用药风险、助力科学监管等方面发挥着重要作用。2023年,为贯彻落实《中人民共和国药品管理法》和《中华人民共和国疫苗管理法》,国家药监局根据《药品质量抽查检验管理办法》等有关要求,“四个最严”为根本遵循,紧紧围绕药品监管实际需求,聚焦重点任务,完善运行机制,创新监管方式,采取“分散抽样、集中检验、探索研究、综合评价”的抽检模式。统筹组织全国31个省(自治区、直辖市)和新疆生产建设兵团遵循分级抽样模式抽取样品;由中国食品药品检定研究院等47个承检机构负责检验样品,构建以问题为导向的药品质量研究评价体系,揭示可能存在的质量安全隐患,同时继续完善风险分级监管机制,对发现的问题随时报告、随时研判、随时处置。另外,通过优化药品抽检模式,探索精准监管、信用监管、智慧监管;部署各省局结合投诉举报、网络监测等探索开展网络抽检,探寻线下线上不同来源药品是否存在质量差异;持续增强中药材质量监测力度等监管策略,进一步提升抽检服务监管的效能。
2023年国家药品抽检共完成132个品种18762批次制剂产品与中药饮片的抽检任务,样品来源涉及1114家药品生产、2528家经营企业和511家使用单位。对检出的136批次不符合规定产品,国家药监局组织各省(自治区、直辖市)和新疆生产建设兵团药品监管部门,及时采取相应的风险控制措施,通过科学分析研判,确定风险点,对涉事企业和单位依法进行查处,对个别企业存在违法违规生产、质量管理水平较低、药品质量保障体系存在缺陷等问题,依风险等级不同分别开展了有因检查、风险提示、督促整改等相应的监管措施。通过对不合格产品查控和信息公开、对风险线索核查处置,对药品从业主体形成了强烈震慑,使其强化了药品全生命周期和全过程质量控制的意识。
二、抽检数据分析
(一)抽样情况
2023年国家药品抽检共抽取制剂产品与中药饮片品种132个,包括化学药品74个、中成药43个、中药饮片9个、生物制品6个,其中国家基本药物品种48个;共抽检样品18762批次,包括生产环节4272批次、经营环节13248批次(其中,互联网环节207批次)、使用环节1242批次(见图1),涉及1114家药品生产企业、2528家药品经营企业和511家药品使用单位。其中,网络抽检涉及的207批次样品经检验均符合规定。各省(区、市)样品抽取情况以及所抽取样品的标示生产企业所在地区抽样分布情况,分别见图2与图3。
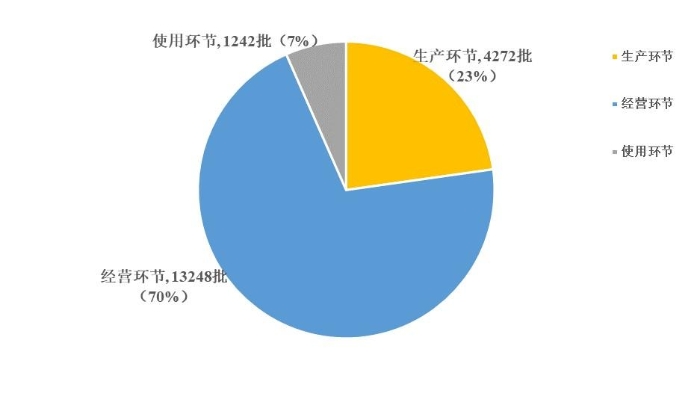
图1. 2023年国家药品抽检各抽样环节抽样情况
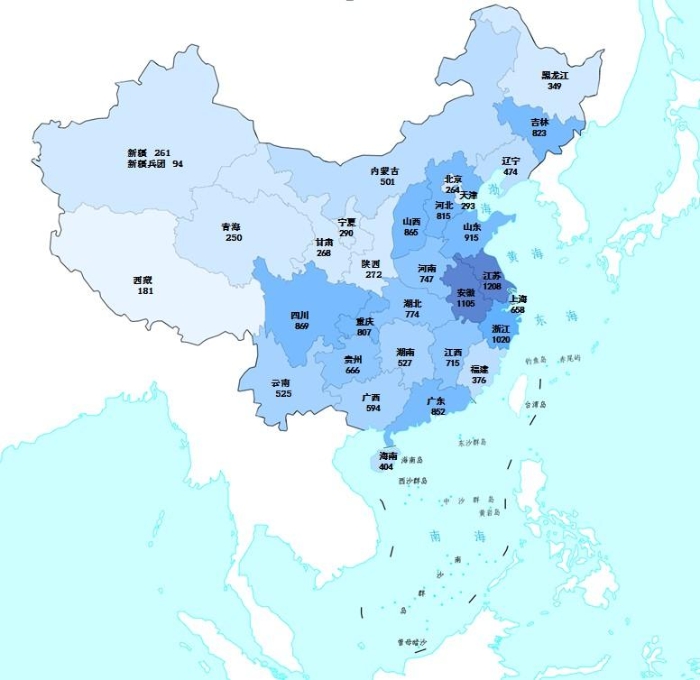
图2.2023年国家药品抽检样品来源分布图
注:图中数字为各省抽样批次数,颜色由浅到深分别表示抽样批次数由低到高。
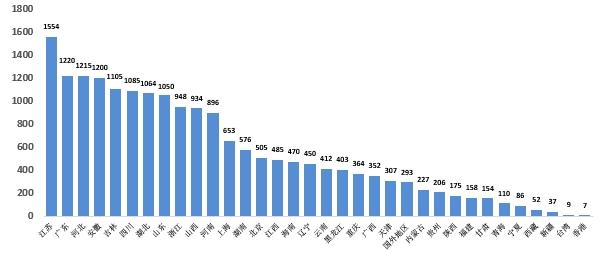
图3. 2023年国家药品抽检样品产地分布图
(二)药品制剂抽检数据分析
2023年国家药品抽检共抽检制剂产品16604批次。经检验,16531批次产品符合规定,73批次产品不符合规定。抽检的123个品种中,全部样品符合规定的制剂品种有106个,共13765批次。其中,化学药品有65个品种9238批次,中成药有35个品种4400批次,生物制品有6个品种127批次。
1.化学药品
2023年国家药品抽检共抽检化学药品74个品种(化学药52个、抗生素12个、生化药10个)10893批次,涉及生产环节2436批次、经营环节7606批次、使用环节720批次、互联网环节131批次。经检验,符合规定10849批次,不符合规定44批次,在生产、经营、使用、互联网检出不符合规定样品2、40、2和0批次,分别占对应环节全部样品的0.1%、0.5%、0.3%和0.0%。(见图4)。
不符合规定项目包括检查和含量测定,不符合规定产品数量依次为9批次、35批次,分别占全部不符合规定项目的20.5%和79.5%(见图5)。
2023年国家药品抽检化学药品共涉及13个剂型,共有6个剂型存在不符合规定样品。其中注射剂(2批次)、片剂(3批次)、颗粒剂(33批次)、软膏剂(4批次)、眼用制剂(1批次)、口服溶液剂(1批次)分别占对应剂型全部产品的0.1%、0.1%、9.1%、1.1%、0.4%和0.2%(见图6)。
抽检结果提示,生产企业应严格原料入厂检验,优化生产工艺管理与关键质量参数控制,重点关注灭菌工艺、原辅料投料量、分装的稳定性,对检查项目及检验指标反映的问题予以深入研究;经营企业应强化药品储存、运输过程管理,提升温湿度监控体系,重点关注需要阴凉、冷藏储存等特殊条件保存的药品;建议监管部门严格审查企业批生产记录,核查原辅料投料量,推动质量标准提升。
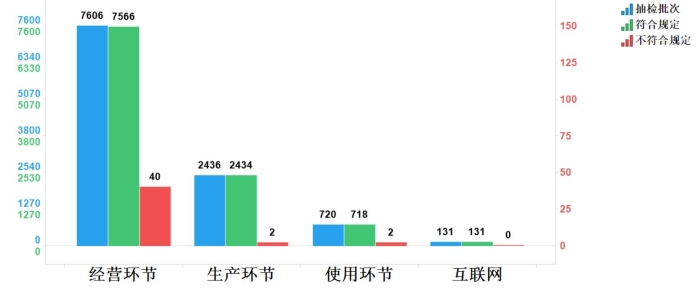
图4.化学药品各抽样环节检验信息示意图
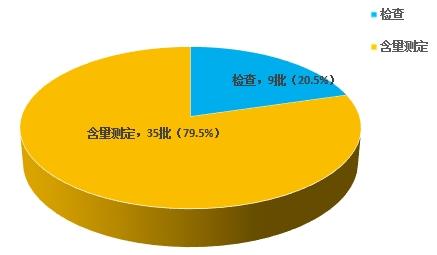
图5.化学药品不符合规定项目分布图
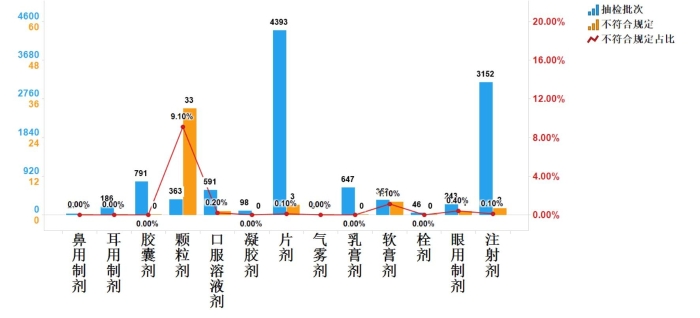
图6.化学药品各剂型检验信息示意图
2.中成药
2023年国家药品抽检共抽检中成药43个品种5584批次,涉及11个剂型,在生产、经营、使用、互联网环节各抽取样品841批次、4619批次、48批次、76批次。经检验,符合规定5555批次,不符合规定29批次,均在经营环节检出,占对应环节全部样品的0.6%(见图7)。
不符合规定项目主要涉及鉴别和检查,不符合规定产品数量依次为10和19批次,分别占全部不符合规定项目的34.5%和65.5%(见图8)。
2023年国家药品抽检中成药涉及11个剂型,共有4个剂型存在不符合规定产品,其中片剂(16批次)、丸剂(7批次)、贴膏剂(4批次)和糖浆剂(2批次),分别占对应剂型全部样品的1.2%、0.5%、2.4%和0.7%(见图9)。
抽检结果提示,生产企业应强化主体责任意识,严把原药材质量关,从源头把控药材质量,严格投料药材入厂检验,加强内部质量控制和生产管理水平,优化生产关键质量参数控制;经营企业应完善药品运输、储存过程管理;建议监管部门加强对生产企业的监督检查,督促其严格按照处方工艺投料,严格执行GMP规范,从而保证中成药的质量及疗效。
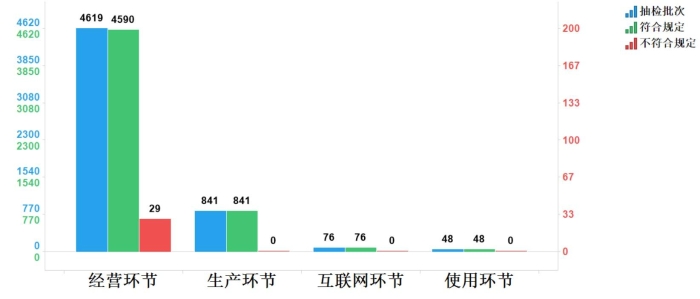
图7.中成药各抽样环节检验信息示意图
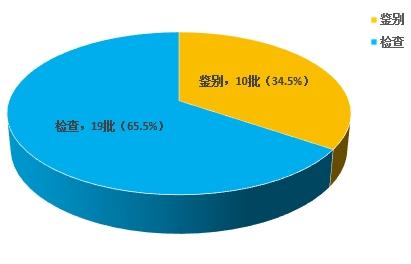
图8.中成药不符合规定项目分布图
注:某些不符合规定产品涉及多个不符合规定项目。
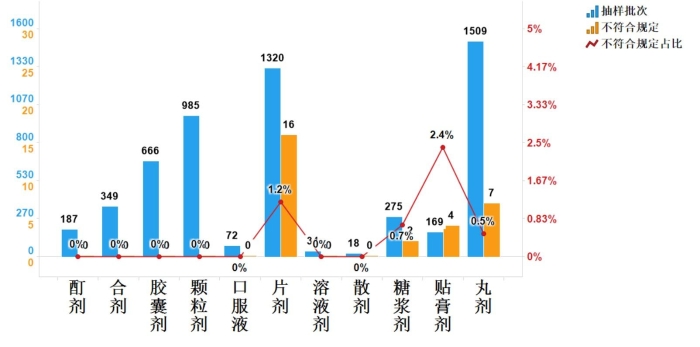
图9.中成药各剂型检验信息示意图
3.生物制品
2023年国家药品抽检共抽检生物制品6个品种127批次,其中生产、经营、使用环节分别抽取50批次、70批次、7批次。其中涉及治疗类品种 5个,预防类品种1个。剂型为注射剂和体外诊断试剂(见图10)。经检验,所检项目均符合规定,合格率为100%。
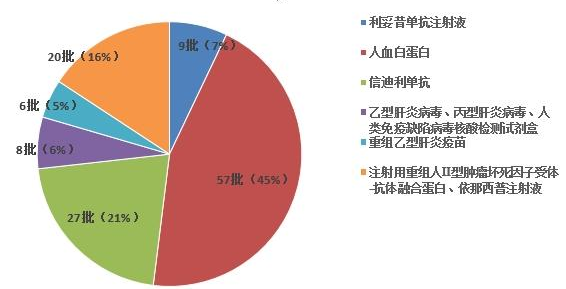
图10.生物制品抽检品种信息示意图
4. 国家基本药物
2023年国家药品抽检共抽检国家基本药物(不含中药饮片)39个品种6140批次,在生产、经营、使用、互联网环节各抽取样品1570批次、4120批次、332批次、118批次。经检验,不符合规定13批次,分别在生产、经营环节检出不符合规定产品1批次和12批次,涉及2个剂型。抽检结果显示,国家基本药物整体质量状况较好(见图11)
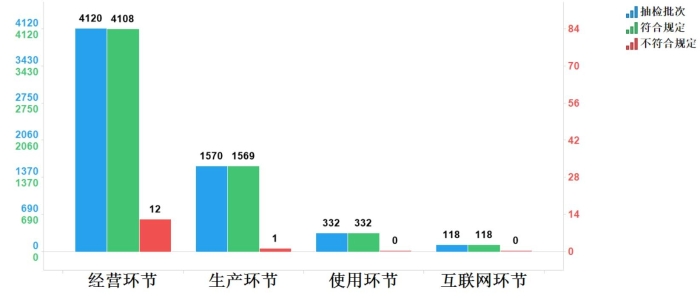
图11.国家基本药物各抽样环节检验信息示意图
5. 国家药品集中采购中选品种
2023年国家药品抽检共抽检国家药品集中采购中选品种20个品种3435批次,在生产、经营、使用、互联网环节各抽取样品887批次、2201批次、290批次、57批次。经检验,集中采购涉及样品均符合规定。抽检结果显示,国家药品集中采购中选品种整体质量状况较好(见图12)。
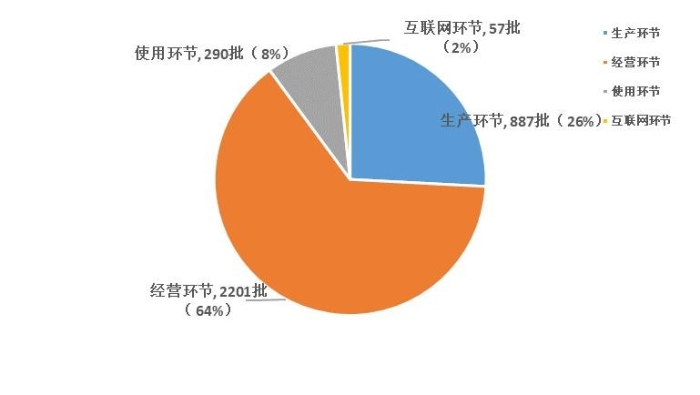
图12. 2023年国家药品集中采购中选品种各环节抽样情况
6.进口药品(不含进口中药材)
2023年,国家药品抽检共抽检进口药品309批次,涉及9个剂型(见图13),其中生产环节11批次、经营环节257批次、使用环节41批次(见图14)。经检验,所检项目均符合规定,合格率为100%。
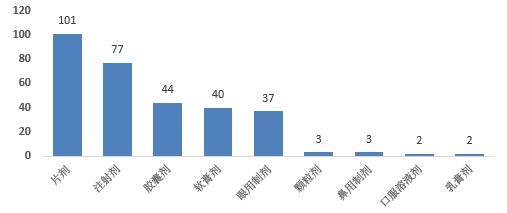
图13.进口药品各剂型检验信息示意图
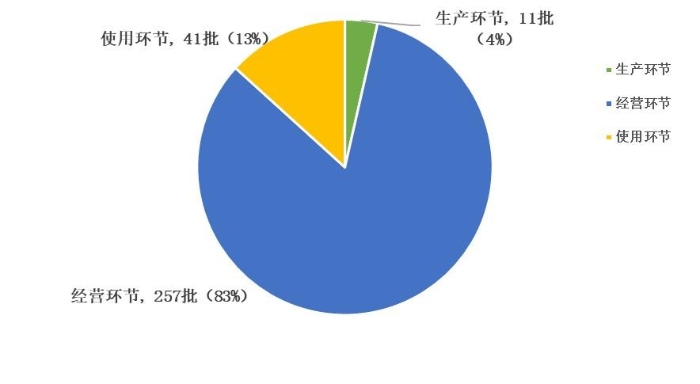
图14. 进口药品各抽样环节检验信息示意图
(三)中药饮片专项抽检及中药材质量监测情况
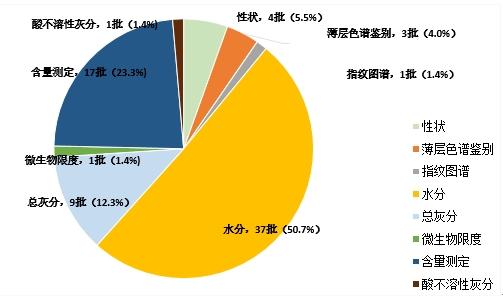
2023年,国家药监局继续组织开展中药饮片专项抽检。全年共抽检9个中药饮片品种2158批次(其中配方颗粒234批,饮片1924批),重点针对可能存在的染色、增重、掺伪或掺假、不规范种植等质量问题,开展检验和探索性研究。经检验,符合规定2095批次,不符合规定63批次(见图15)。
不符合规定项目主要涉及性状(4批次)、薄层色谱鉴别(3批次)、微生物限度(1批次)、含量测定(17批次)、指纹图谱(1批次)、总灰分(9批次)、水分(37批次)、酸不溶性灰分(1批次)等方面,分别占全部不符合规定项目的5.5%、4.0%、1.4%、23.3%、1.4%、12.3%、50.7%、1.4%。(见图16)
同时,为贯彻落实《中华人民共和国中医药法》有关要求,国家药监局继续组织开展中药材质量监测,组织对部分药品生产企业、药材市场集散地或种植集中区的中药材质量进行监测。2023年中药材质量监测,共监测9个品种251批次样品,其中,药品生产企业224批次,市场集散地或种植集中区27批次。所有样品按照不同品种特点,针对相应项目进行了研究性检验,主要针对掺杂掺伪、加工炮制规范、农药残留等问题开展。
2023年中药饮片专项抽检及中药材质量监测发现的主要问题有:一是混伪品掺伪问题,如硼砂蚕掺伪僵蚕(炒僵蚕)、理枣仁掺伪酸枣仁;二是非法染色问题,如炒酸枣仁检出胭脂红;三是外源性有害物质残留超限问题,部分饮片存在真菌毒素残留、农药残留、重金属及有害元素超标等隐患,如部分批次麸炒薏苡仁黄曲霉毒素及玉米赤霉烯酮超标、部分批次炒酸枣仁及炒酸枣仁配方颗粒黄曲霉毒素B1超标、部分批次地骨皮检出禁用农药氟虫氰、部分批次地骨皮重金属超出通则限量规定、部分批次丹参及丹参配方颗粒、甘草及甘草配方颗粒检出植物生长调节剂等;四是采收加工与加工炮制不规范问题,如酸枣仁、女贞子等存在抢青采收导致质量下降,地骨皮产地加工泥沙清洗不完全,防己存在产地趁鲜加工现象。
抽检及监测结果显示,我国中药饮片总体质量状况良好。但中药饮片全产业链参与者应进一步提高质量意识和责任意识,中药饮片生产企业应提升全程质量控制意识,首先加强药材溯源、供应商资质审核管理,重点关注原料掺伪、有害物质残留等问题,做好原料管控,其次生产前做好工艺验证,生产中严格遵照炮制规范要求执行,第三把好检测及贮存环节管理关口,保证饮片质量的真实稳定;药品行政管理部门应督促药品上市许可持有人严格控制工艺规程与购进药材质量,继续强化中药材及饮片的市场监测。
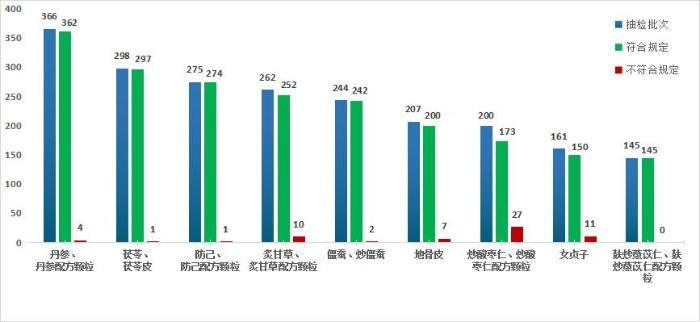
图15.2023年中药饮片专项抽检结果
图16. 2023年中药饮片专项抽检不符合规定项目分布图
注:某些不符合规定产品涉及多个不符合规定项目。
(四)探索性研究
2023年,在多年技术储备的基础上,各药品检验机构法定药品标准方法与探索性研究方法检验并重,充分利用探索性研究的利器,全面考察药品质量的稳定性、现行标准的可行性,同时探寻可能存在的潜在风险,为提升药品质量标准、提高监督管理水平提供科学可靠的技术支撑。发现的主要问题有:
一是中药饮片混用掺伪问题,使用伪品、掺伪的中药材及饮片生产中药制剂的问题仍然存在;二是个别企业违法违规生产问题仍然存在,如擅自改变生产工艺,低限或使用掺伪、替代品投料,违反关键工艺制法,擅自改变或添加辅料、防腐剂和抑菌剂等;三是不同厂家因原料药质量差异、生产工艺不稳定等原因,导致产品均一性较差;四是外源性有害物质超限,部分品种重金属、农药、真菌毒素残留量超限;五是包装材料相容性问题影响产品质量稳定性。
三、抽检结果应用
药品抽检作为药品监管的重要手段,在发现药品质量风险、打击违法违规行为中发挥着不可替代的重要作用,是实现科学监管、严格监管的重要技术支撑。国家药品抽检的目的不仅仅是把控风险、规范生产和保障药品质量安全,其成果的积极运用更是持续提升药品质量,推动产业提质升级的重要途径。
(一)推进政策支撑,完善抽检制度体系建设
国家药监局持续加强抽检制度建设和顶层设计,推动抽检工作更加科学。2023年,印发《关于进一步做好地方药品抽检有关工作的通知》,对地方抽检工作提出更为明确且具体的要求,加强国家与地方抽检的衔接互补;持续推进药品抽检制度体系优化创新,健全完善抽检工作机制和工作程序,推进修订《药品抽检探索性研究原则及程序》,规范指导探索性研究;修订《药品抽样原则及程序》,细化完善中药材和中药饮片的取样、制样方法,探索网抽购样方式方法。着力提升服务药品监管实际需求的能力。
(二)聚焦社会热点,主动开展专项风险监测
近年来,药品安全突发事件是公众和媒体关注的焦点,随着检测分析技术的日新月异,一些已上市成熟药品中未曾暴露的质量安全性问题被逐渐揭示。配合国家重大医药政策执行,聚焦社会热点、潜在风险点、监管的难点堵点等,国家药品抽检每年设置不同专项,对国家集采中选、儿童用药、生物制品等重点品种进行专项研究,为科学监管提供技术支撑。针对可能的风险点,2023年还专门设置马兜铃酸研究、溶剂残留研究、网络抽检等专项,潜在风险得到有效控制,例如针对境外报道糖浆剂出现乙二醇/二甘醇污染情况,开展溶剂残留研究,其中部分专项研究成果还被国际认可,如溶剂残留研究的工作成果已被收入《国际药典》。
(三)深入排查风险,查控假劣药品
2023年,国家药监局依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险关闭、警示用药安全。组织各省级药品监管部门对国家药品抽检发现的136批次不符合规定产品,在第一时间采取了查封扣押、暂停销售使用、要求企业主动召回等风险控制措施;对涉及的相关企业和单位均依法组织查处;同时要求药品生产企业认真排查,督促其查找问题原因并切实整改,确保质量安全隐患得到及时有效清除。通过药品抽检严厉打击了制售假劣药品的行为,发挥了震慑不法企业、净化市场环境的作用。此外,国家药监局在2023年共发布药品补充检验方法4个,为打击隐蔽性极强的掺杂掺假等违法行为提供了监管利器,也为企业提供了保障药品质量安全的科学依据。
(四)深化风险提示,寓服务于监管
对探索性研究中发现的有关生产工艺、处方、原辅料、包装材料、说明书等方面可能存在的一般性问题,药品监督管理部门通过“药品质量提示函”等形式反馈相关企业,提升企业的质量意识,加强企业主体责任的落实。例如,盐酸倍他司汀片的探索性研究发现,部分企业湿法制粒后干燥时间过长可能影响蔗糖含量,提示应当优化生产工艺参数;止咳宁嗽胶囊的探索性研究发现,部分批次产品苦杏仁苷含量偏低,提示企业应当加强原药材质量管控。
相关企业主动采取修订内控标准、完善工艺、加强供应商审计、修订说明书等整改措施,提升产品质量水平;各省局也通过多部门联席会、约谈企业、风险沟通、跟踪检查等方式,利用提示信息强化对企业的监督指导。通过寓服务于监管的风险提示,加深了监管部门、药检机构和企业之间的信任与理解,促进了持有人主体责任的落实,是主动排查、预防为主监管方式的有益探索。
(五)及时信息公开,助力智慧监管
国家药监局继续以通告的形式,依法及时向公众警示不符合规定药品抽检信息,筑牢公众用药安全防线,2023年共发布药品抽检通告7期,对全部不符合规定药品及涉及企业依法公开,震慑不法企业、警示安全用药。中检院在官方网站持续公开国家药品抽检的探索性研究结果,2023年共发布39个品种的新建检验方法。通过信息的共享利用,进一步促进药品上市许可持有人及相关生产经营企业的质量安全意识和主体责任自律意识,增强药品质量风险控制能力,促进产品研发创新升级。
四、结语
2023年国家药品抽检工作顺利完成。检验及研究结果显示,我国药品质量仍处于较高水平,整体安全形势稳中向好。
2024年是中华人民共和国成立75周年,是实施“十四五”规划的关键一年,国家药监局将认真落实习近平总书记关于药品监管工作的重要指示批示精神,将“四个最严”要求贯彻落实到每一个具体的监管实践中,进一步强化风险意识,持续筑牢药品安全底线,提升药品监管效能,加快构建更加科学高效权威的药品上市后监管体系,推动我国从制药大国向制药强国跨越,更好地保障人民群众用药安全。
小贴士
1.药品抽检历史沿革
1956年,我国首次提出药品计划抽检的概念;1964年,原卫生部第一次制定国家级年度药品抽检计划并组织实施;1984年颁布《中华人民共和国药品管理法》,第一次从法律上明确了药品抽检工作的地位;1986年,实行药品质量公报制度;1990年,实行药品抽检收费制度,即抽检药品须由被抽检单位付检验费;2001年,《中华人民共和国药品管理法》修订,取消了药品抽检收费制度,所需费用由财政列支;2019年,《中华人民共和国药品管理法》再次修订,明确“药品监督管理部门根据监督管理的需要,可以对药品质量进行抽查检验”、“抽样应当购买样品”。
2.药品标准检验
药品标准检验是指具有检验资质的药品检验机构,依据国家药品监督管理部门批准的法定检验标准中的检验方法,进行全项目或部分项目的检验,并依法出具检验报告书的过程。
3.探索性研究
探索性研究是指在药品抽检中,除按照药品标准进行检验并判定药品是否符合标准规定之外,根据监管工作需要,进一步针对抽检样品可能存在的质量风险,采用药品标准以外的检验项目和检测方法对药品质量进行进一步分析研究的过程,可为防控潜在风险隐患、提升药品质量水平、加强药品监管提供技术支撑。
4.国家基本药物
国家基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。《国家基本药物目录(2018年版)》中的药品包括化学药品和生物制品、中成药、中药饮片3部分,其中,化学药品和生物制品主要依据临床药理学分类,共 417个品种;中成药主要依据功能分类,共268个品种;中药饮片不列具体品种,颁布国家标准的中药饮片为国家基本药物,国家另有规定的除外。
5.药品补充检验方法
药品补充检验方法和检验项目(药品补充检验方法)适用于有掺杂、掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的药品检验。经国务院药品监督管理部门批准后,使用补充检验方法和检验项目所得出的检验结果,可以作为药品监督管理部门认定药品质量的依据。
6.检验项目
性状项下记载药品的外观、臭、味、溶解度以及物理常数等,在一定程度上反映药品的质量特性。
鉴别项下规定的试验方法,系根据反映该药品的某些物理、化学或生物学等特性所进行的药物鉴别试验,不完全代表对该药品化学结构的确认。
检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需控制的杂质(如残留溶剂、有关物质等);改变生产工艺时需另考虑增修订有关项目。
含量测定项下规定的试验方法,用于测定原料及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
附表

《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-

-