条件成熟 我国实施UDI已箭在弦上
- 2019-05-14 11:18
- 作者:
- 来源:国家药监局UDI专家组
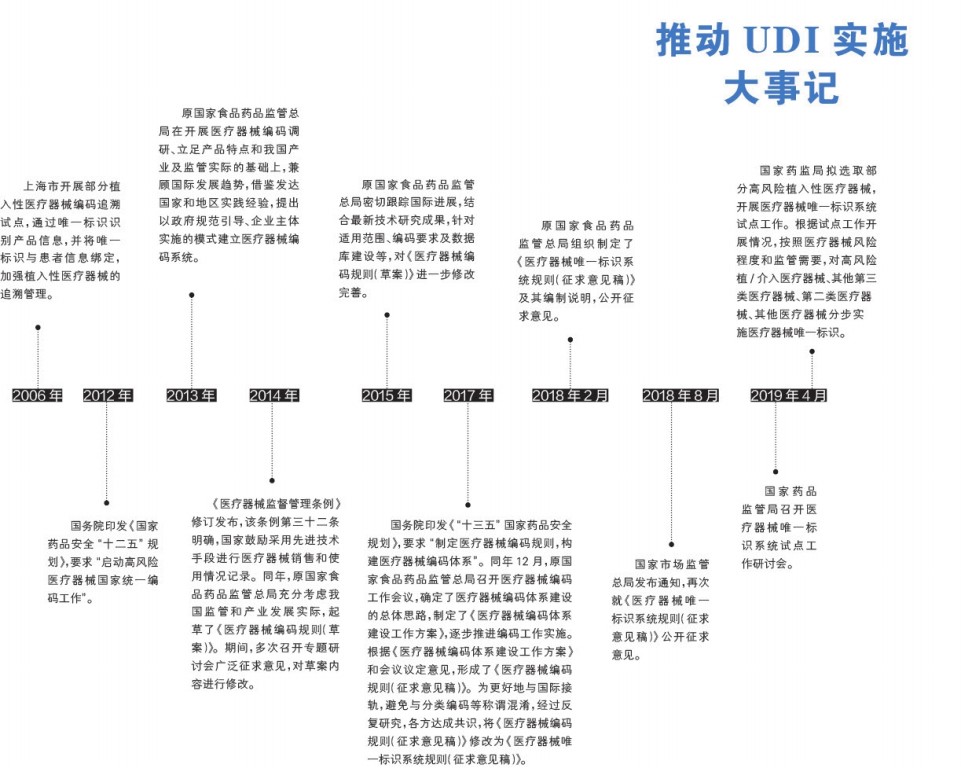
医疗器械唯一标识(UDI)的实施已经成为世界潮流,我国UDI的实施工作也在有条不紊地推进中。近日,国家药品监管局召开医疗器械唯一标识系统试点工作研讨会,讨论《医疗器械唯一标识系统试点工作方案》,并决定选取部分高风险医疗器械品种作为实施UDI的第一批试点。
为了解我国医疗器械赋码的实际情况,以及医疗器械生产企业采用的编码标准和编码使用量分布情况,国家药品监管局组织专业人员赴部分医疗器械生产、经营企业和使用单位调研,对我国实施UDI的现实基础进行了全面摸底。
整体情况三类产品赋码率达86%
物联网专委会“医疗器械行业基础数据平台”的数据显示,该平台现有50家医疗机构和4999家医疗器械企业数据,其中生产企业2257家,经营企业2742家,填报注册证13287个,医疗器械产品数据41万余条。
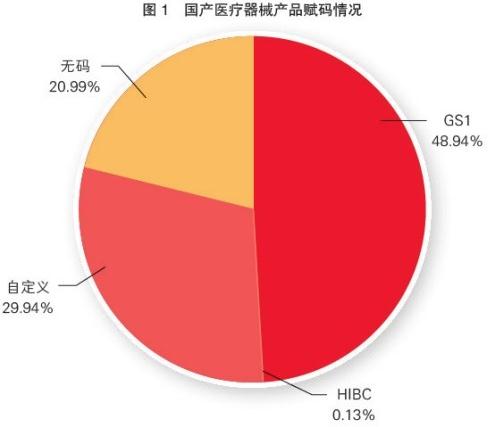
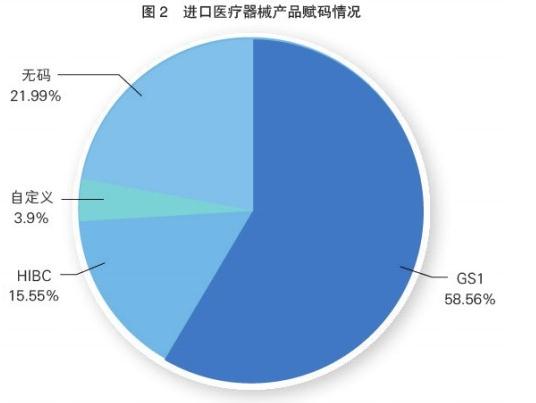
对该平台的产品赋码情况分析可知,从产品国别看,国产医疗器械产品信息共25.5万条,其中使用GS1(全球统一编码标识系统)和HIBC(医疗保健行业条码)编码的有12.5万条,约占49%;使用自定义编码的有7.7万条,约占30%;无码产品5.3万条,约占21%(见图1)。进口医疗器械产品信息共15.7万条,其中使用GS1和HIBC编码的有11.6万条,约占74%;使用自定义编码的有0.6万条,约占4%;无码产品3.4万条,约占22%(见图2)。
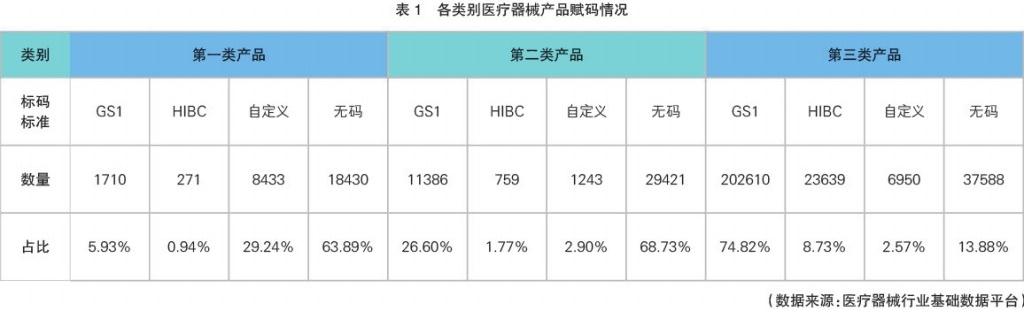
从产品管理类别看,第三类医疗器械赋码率最高,约占86%,其中使用GS1和HIBC编码的产品约占83%;第一类、第二类医疗器械的赋码率较低(见表1)。
从产品种类看,高值医用耗材赋码率达到87%,其中使用GS1编码的产品约占86%,使用HIBC编码的产品约占11%,自定义编码的产品占3%,无码产品约占13%。赋码的高值医用耗材中,植入材料和医用介入材料约占95%。自定义编码产品主要为国产体外诊断试剂,无码产品主要为普通低值耗材。
先试先行上海试点植入性器械编码
2006年起,上海市将UDI引入植入性医疗器械的追溯与监管工作,通过UDI识别产品信息,并将UDI与患者信息绑定,加强植入性医疗器械的追溯管理。
2006年10月,上海市药品监管部门和上海市卫生行政部门开展植入性医疗器械追溯管理试点,并发布了《上海市关于进一步加强本市植入性医疗器械管理的意见》,规定自2007年1月1日起在植入性医疗器械生产和经营企业开始试行,2007年4月1日起在医疗机构试行。其中,纳入追溯试点范围的植入性医疗器械包括:骨科内固定植入器材、人工关节、人工晶体、人工乳房、植入式心脏起搏器、人工心脏瓣膜、血管或腔道内导管支架、介入性治疗导管器材以及其他金属或高分子植入器材等。
上海市植入性医疗器械编码的载体要求采用一维条形码,编码标准采用GS1和HIBC两种,编码组成包括器械标识(静态)和生产标识(动态)。数据库的建立与管理统一由第三方机构负责,数据的提交采用时间节点上报的方式。
经过几年的试点,上海市植入性医疗器械已实现本市范围内编码追溯管理,且追溯所能达到的最小单位为批号或序列号。编码的使用大大提高了追溯的工作效率和准确率,这一点在医疗器械使用环节中体现得更为充分——医疗机构通过扫描条形码,直接从后台数据库下载产品的相关信息,既避免产品相关资料人工录入的错误,又实现了医疗器械的实际使用与编码信息同步化。植入性医疗器械编码规定的实施也间接促使医院对HIS系统(医院信息管理系统)的升级更新。
总体上看,上海市植入性医疗器械编码工作实施的成效值得肯定,但在试点过程中也发现一些问题,在数据库设计、管理和数据使用率方面仍有待改善。
随着全球医疗器械监管机构对UDI的高度关注,我国医疗器械行业对UDI的认知也不断提升,医疗器械产品的赋码比例逐步提高。值得注意的是,国产、进口医疗器械的赋码率总体差异不大,赋码产品约占80%,无码产品约占20%。但国产医疗器械采用自定义编码的现象比较普遍,约占30%,而进口医疗器械约占4%。
从有关数据看,赋码产品中第三类医疗器械赋码率最高,特别是高值医用耗材中骨科产品和介入产品的赋码率最高,表明我国实施UDI具备一定的产业基础,且从高风险植入医疗器械开始实施UDI更具有合理性和可操 作性。
建言献策立足国情还需规范引导
我国实施UDI虽然具备了相应的基础条件,但也有一些迫切需要解决的问题。
一是UDI的概念混淆,缺乏行业共识。目前,医疗器械行业中存在多种编码类型,主要包括分类编码、产品标识编码、收费编码等,行业内对UDI的理解和认识还需统一。
二是编码主体繁多,责权不够明晰。由于当前行业没有统一的UDI数据系统,导致医疗器械经营企业无法直接解析和使用生产企业的UDI,而是使用自定义条码。医疗机构也存在类似情况,甚至要求供应商按照医院的规则进行贴码。由于源头编码不能一码到底,导致编码的应用不成体系,信息无法共享,编码应用效果受到限制。
三是编码方式多样,缺乏相关标准。由于目前行业各主体使用编码多从自身需求出发,自创一套编码标准,存在编码组成不标准、编码方式不规范等问题。
四是缺乏统一的信息系统,数据基础薄弱。由于只有生产企业掌握产品信息与UDI的对应关系,导致其他各方无法直接通过扫码获取产品信息,经营企业、医疗机构和监管部门若要使用UDI,必须自己建立对应的数据库,这就限制了UDI的广泛使用,因此,亟须建立一套统一的信息系统,支持各方应用。
综上所述,实施UDI需要积极统筹,稳步推进。首先,要通过UDI规则引导和推动各方积极应用;其次,要建立UDI标准体系,包括编码标准、载体标准、通信协议标准、数据元标准等;第三,要建立UDI数据库,搭建医疗器械注册、上市后再评价和上市后监管共享的基础数据平台;第四,在推进速度上,可先选取部分基础相对较好的产品开展试点,对于基础相对薄弱的领域,根据监管需要和产业实际稳步推进;第五,依托社会力量,鼓励行业协会等机构积极开展UDI应用探索。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有











