国家药品抽检年报(2019)全文发布
- 2020-03-23 21:50
- 作者:
- 来源:中国食品药品检定研究院网站
3月23日,中国食品药品检定研究院网站发布《国家药品抽检年报(2019)》。全文如下。
国家药品抽检年报(2019)
2019年,国家药监局按照“四个最严”要求,坚持问题导向和风险防控原则,紧密围绕药品监管需求,在全国范围内组织对生产、经营、使用环节的部分品种开展质量抽查检验工作,并大力推进药品抽检工作的规范性、科学性、靶向性,充分发挥抽检工作在药品监管中的技术支撑作用。2019年国家药品抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。
一、概述
药品抽检是药品监管部门根据药品监督管理的实际需要,依法对生产、经营和使用的药品所采取的质量抽查检验工作,其目的是为了评价某类或一定区域内药品质量状况,探寻影响药品质量安全的潜在问题或安全隐患,维持震慑,消除隐患,保障公众用药安全有效,助推药品产业高质量发展。
为落实《中华人民共和国药品管理法》,强化药品质量监管,国家药监局持续加强药品抽检管理的制度建设,在2019年组织修订并印发了《药品质量抽查检验管理办法》,发布了《药品抽样原则及程序》,明确了药品抽检是对上市后药品监管的技术手段,应当遵循科学、规范、合法、公正原则。
国家药品抽检目前采取“分散抽样、集中检验、探索研究、综合评价”的工作模式,即在全国范围内组织抽取样品,同一品种的全部样品交由同一药品检验机构集中检验,在检验样品是否符合标准规定的基础上,结合文献查询、市场调研、现场考察等,围绕抽检品种可能存在的安全性、有效性问题,开展有针对性的探索性研究,从生产投料、工艺处方、质量标准、原辅料质量及使用、包装材料、说明书和标签等方面探寻可能存在的问题,为持续提升药品质量水平和药品监管能力提供技术支持,服务药品监管。
2019年国家药品抽检共完成184个品种15612批次产品的抽检任务,样品来源涉及4551家药品生产、经营企业和使用单位,覆盖境内全部31个省、自治区和直辖市,由43家药品检验机构承担检验和探索性研究任务。对经检验不符合规定的178批次产品,国家药监局组织各省级药品监管部门及时采取了有效控制措施,对涉事企业和单位开展调查核实并依法处理,同时要求相关企业开展问题原因排查并及时整改。对在探索性研究中发现个别企业涉嫌存在的违法违规生产和质量管理水平较低等问题,依风险不同,国家药监局分别组织开展了现场检查、风险提示、督促整改等相应的监管措施。
二、抽检数据分析
(一)抽样情况
2019年国家药品抽检共抽取制剂产品与中药饮片品种184个,包括化学药品112个、中成药57个、生物制品8个和中药饮片7个,其中属于国家基本药物品种94个;共完成抽样15612批次,包括生产环节1909批次、经营环节10025批次和使用环节3678批次(见图1),涉及667家药品生产企业、2535家药品经营企业和1349家药品使用单位,各省(区、市)样品抽取情况以及所抽取样品的标示生产企业所在地区抽样分布情况,分别见图2与图3。
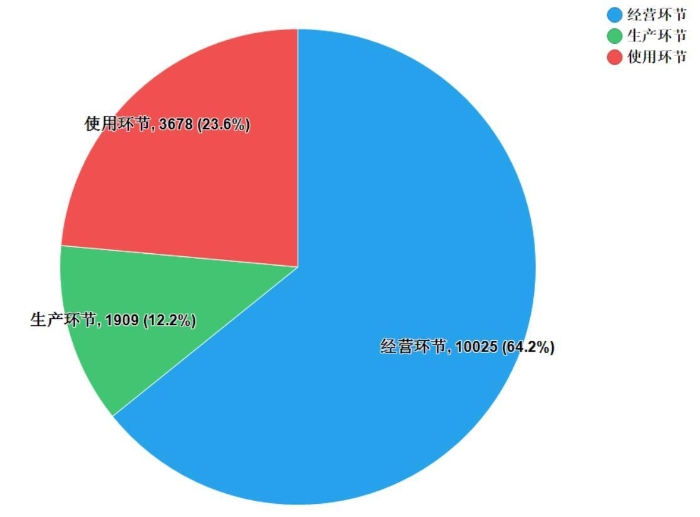
图1.生产、经营、使用环节抽样情况
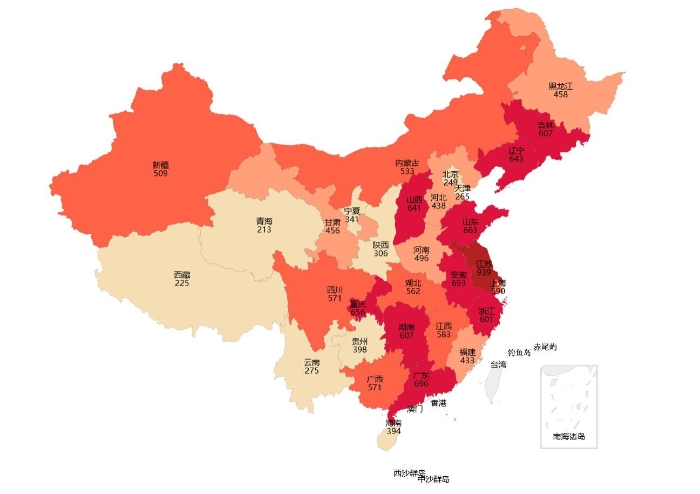
图2.抽检样品来源分布图
(注:图中数字为各省抽样批次数,圆点由小到大分别表示抽样批次数由低到高)
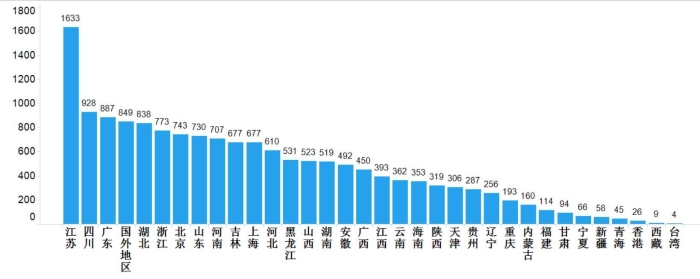
图3.抽检样品产地分布图
(二)药品制剂抽检数据分析
2019年国家药品抽检共抽检制剂产品14269批次。经检验,符合规定14212批次,不符合规定57批次,其中有2批次药品系按照补充检验方法检出其他植物组织。抽检的177个品种中,全部样品符合规定的药品制剂有158个,共11446批次。其中,化学药品有102个品种6335批次、中成药有48个品种4931批次、生物制品有8个品种180批次。
2019年国家药品抽检数据显示,制剂产品合格率为99.6%,总体质量处于较高水平。
1.化学药品
2019年国家药品抽检共抽检化学药品112个品种7912批次,涉及22个剂型,在药品生产、经营、使用环节各抽样品886、4646、2380批次。经检验,符合规定7881批次,不符合规定31批次,分别在经营与使用环节检出不符合规定产品28和3批次,分别占对应环节全部样品的0.6%和0.1%(见图4)。
不符合规定产品主要涉及6个剂型,其中片剂(13批次)、注射剂(7批次)、冻干注射剂(1批次)、胶囊剂(1批次)、口服溶液剂(7批次)、吸入溶液剂(2批次),分别占对应剂型全部产品的0.5%、0.5%、0.1%、0.1%、1.7%、1.5%(见图5)。
不符合规定项目主要涉及检查、性状和含量测定,不符合规定产品数量依次为20、11和2批次,分别占全部不符合规定项目的60.6%、33.3%和6.1%(见图6)。
抽检数据显示,经营环节出现不符合规定情况高于生产、使用环节,提示药品经营企业要注意检查产品包装密封,完善药品贮存、运输环节的温湿度控制体系,重点关注需冷藏、避光贮存的药品;药品生产企业应加强过程管理,严格控制口服溶液剂等剂型品种的生产工艺关键步骤,提高工艺的稳定性和无菌保障能力。
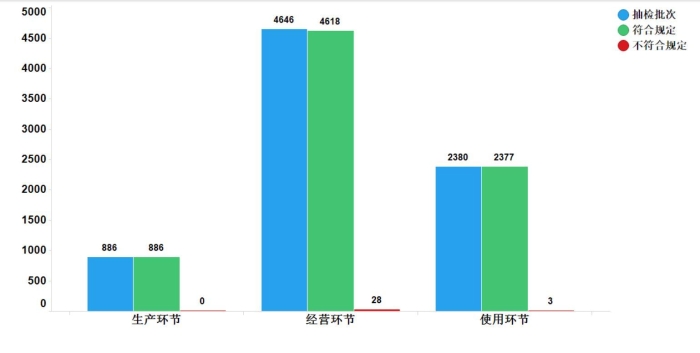
图4.化学药品各抽样环节检验信息示意图
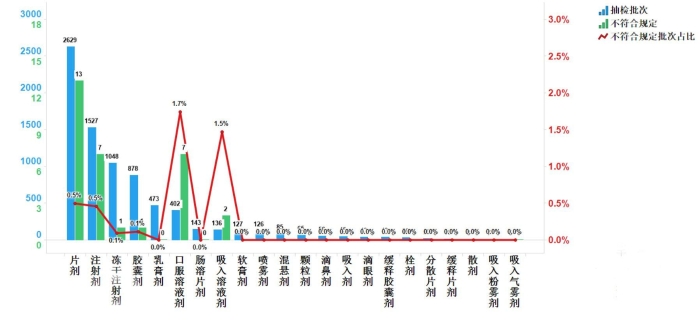
图5.化学药品各剂型检验信息示意图
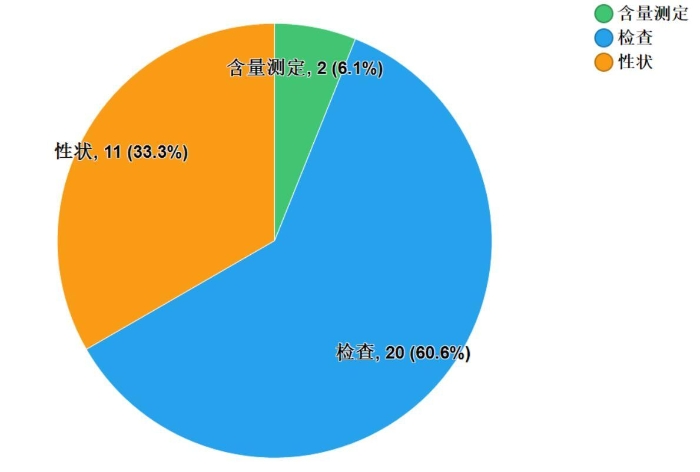
图6.化学药品不符合规定项目分布图
(注:某些不符合规定产品涉及多个不符合规定项目)
2.中成药
2019年国家药品抽检共抽检中成药57个品种6177批次。经检验,符合规定6151批次,不符合规定26批次(含2批次补充检验不符合规定)。生产、经营、使用环节分别抽取中成药634、4805、738批次,在生产与经营环节各检出不符合规定产品3和23批次,占对应环节全部产品的比例均为0.5%(见图7)。
不符合规定项目主要集中在检查与含量测定两项。不符合规定产品数量依次为18和6批次,分别占全部不符合规定项目的69.2%和23.1%(见图8)。
抽检数据显示,口服制剂产品的不符合规定批次占比较高(见图9),提示有关企业应加强全过程质量控制,加强购进药材和原辅料的质量管理,应严格控制生产工艺关键步骤,提高工艺稳定性,优化包装条件等。
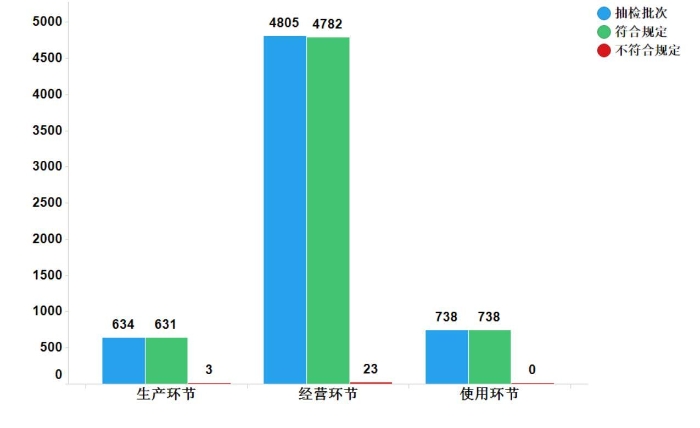
图7.中成药各抽样环节检验信息示意图
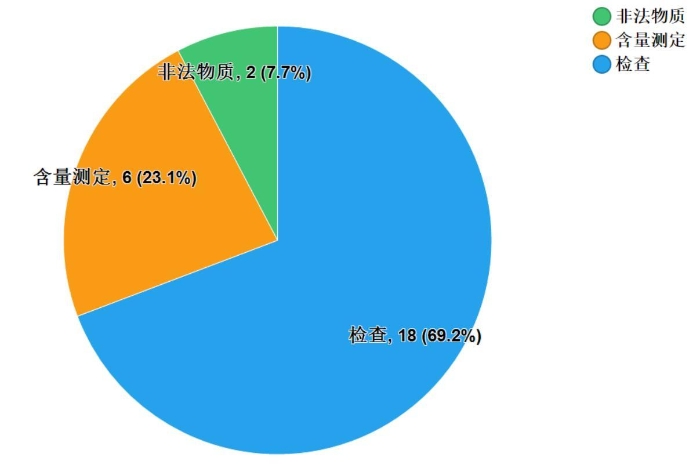
图8.中成药不符合规定项目分布图
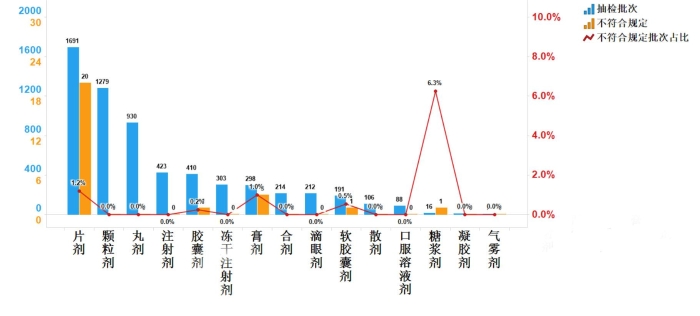
图9.中成药各剂型检验信息示意图
3.生物制品
2019年国家药品抽检共抽检生物制品8个品种180批次,其中生产、经营、使用环节分别抽取91批次、36批次、53批次(见图10)。涉及治疗类品种2个、预防类品种5个、诊断类品种1个,共计2个剂型(见图11)。经检验,所检项目均符合规定,合格率为100%。
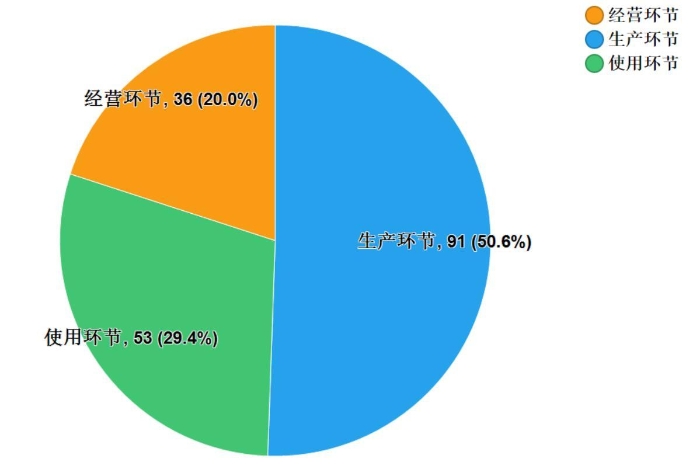
图10.生物制品各抽样环节检验信息示意图
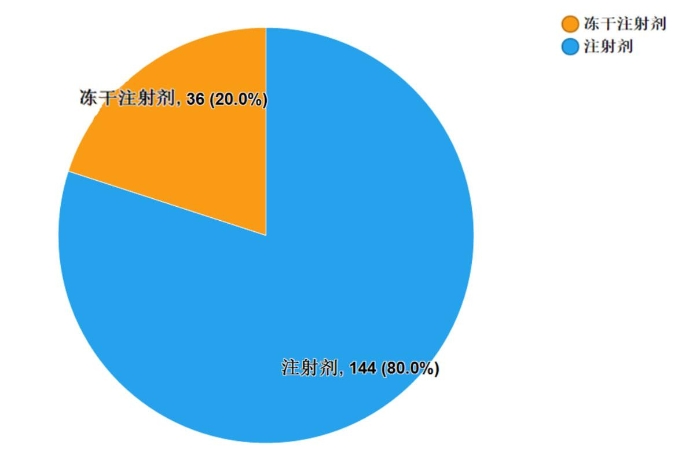
图11.生物制品各剂型检验信息示意图
4.基本药物
2019年国家药品抽检共抽检国家基本药物(不含中药饮片)8889批次,经检验,符合规定8872批次,合格率99.8%。其中抽取生产、经营、使用环节各1095、5416、2378批次,在经营环节检出不符合规定产品17批次。
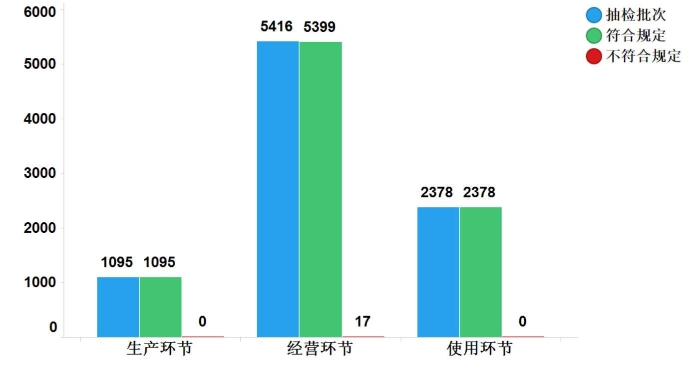
图12.国家基本药物各环节检验信息示意图
5.“4+7”中选品种专项
2019年国家药品抽检设置了“4+7”中选品种专项,以保障药品集中采购和使用试点期间中标药品的质量。
2019年共抽检“4+7”城市药品集中采购中选的25个品种98批次,涉及6个剂型,其中在生产、经营环节分别抽取样品88、10批次(见图13),覆盖了全部集中采购中标企业。经检验,所检项目均符合规定,合格率为100%。
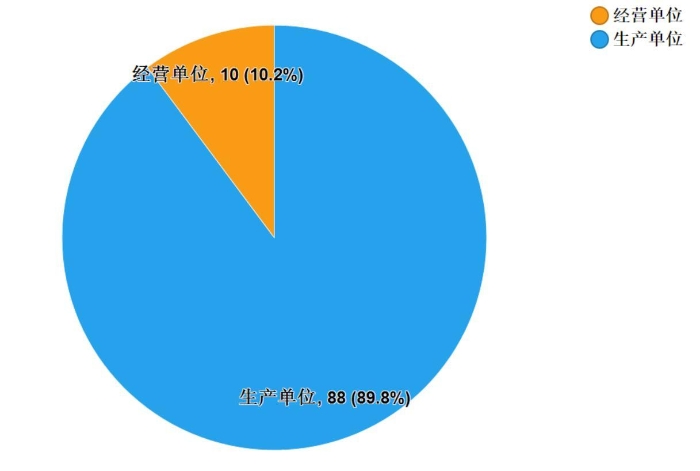
图13.“4+7”中选品种各抽样环节检验信息示意图
6.进口药品(不含进口中药材)
2019年,国家药品抽检加大了对进口药品的抽检力度,共抽检进口药品874批次,涉及15个剂型(见图14),其中生产环节(进口口岸)、经营环节与使用环节分别抽取8批次、374批次和492批次(见图15)。经检验,所检项目均符合规定,合格率为100%。
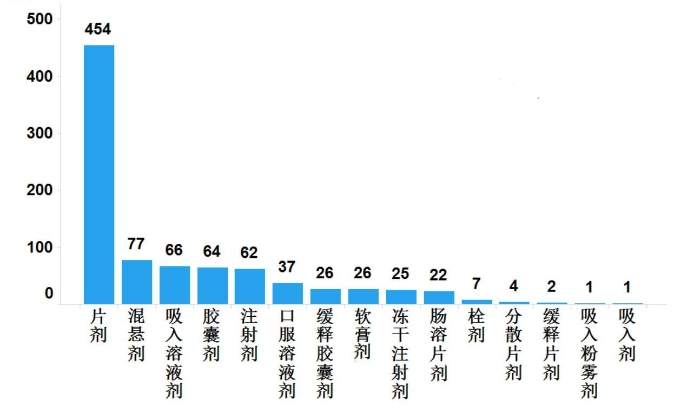
图14.进口药品各剂型与抽样环节检验信息示意图
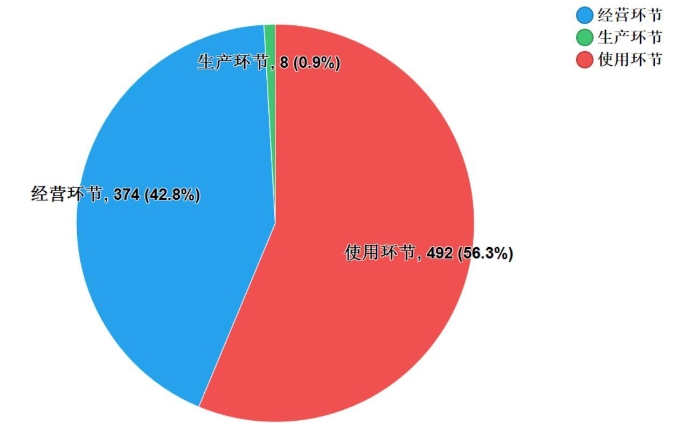
图15.进口药品各抽样环节检验信息示意图
(三)中药饮片专项抽检情况
2019年国家药监局组织开展了中药饮片专项抽检。主要针对近年来销量较大、使用范围较广的中药饮片常出现的掺假染色、外源性污染问题,以及因炮制、贮存方法不当等造成的质量问题,开展检验和探索性研究。
2019年,国家药品抽检共抽检7个中药饮片1343批次样品。经检验,符合规定1222批次,不符合规定121批次(见图16)。不符合规定项目主要涉及性状(72批次)、主成分含量测定(37批次)、醇不溶物(2批次)、鉴别(5批次)、浸出物测定(2批次)、水分(6批次)等方面,分别占全部不符合规定项目的58.2%、29.8%、1.6%、4.0%、1.6%和4.8%(见图17)。
2019年国家药品抽检发现的主要问题有:一是混伪品掺杂、以次充好问题,如半夏为虎掌南星混用或掺伪,用栽培品防风经焦糖染色后充当野生品,血竭中掺入龙血竭等;二是炮制不规范、染色问题,如部分批次半夏未检出炮制的指标成分甘草次酸,部分批次血竭检出人工色素。抽检结果提示,中药饮片生产企业应规范产地加工,严格遵守炮制规范和贮运条件,加强进厂或投料前检验,积极落实质量主体责任。
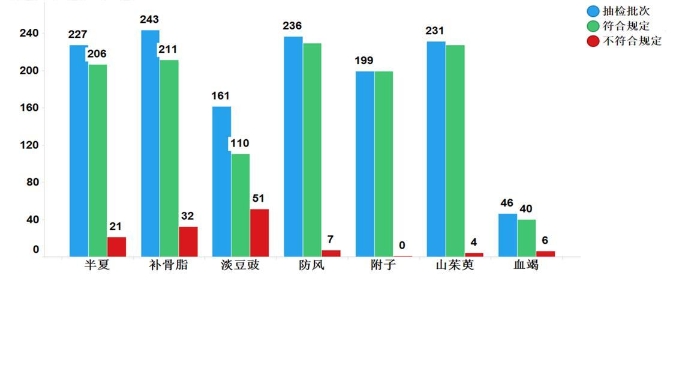
图16.2019年中药饮片专项抽检结果示意图
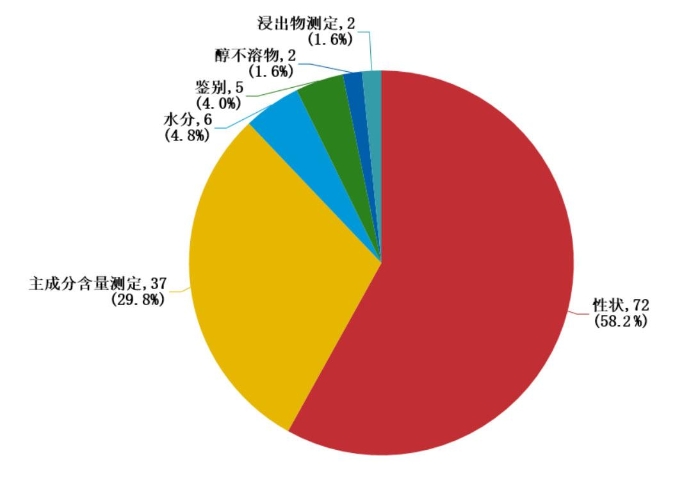
图17.2019年中药饮片专项不符合规定项目分布图
(注:某些不符合规定产品涉及多个不符合规定项目)
(四)探索性研究
为深入挖掘抽检品种的潜在风险,助力药品质量持续提升。2019年,各药品检验机构在按照现行法定标准检验的基础上,根据抽检品种可能存在的不同问题,针对性地开展探索性研究。2019年国家药品抽检探索性研究发现的主要问题有:一是个别企业违法违规生产,包括低限或使用掺伪、替代品投料,违反关键工艺制法,非法染色等;二是中药饮片掺伪染色、以次充好,并用于成方制剂生产问题;三是部分品种重金属、微生物、农药残留超限;四是生产工艺参数设置不合理或控制水平低,导致内在质量存在差异或交叉污染;五是部分生产企业对包材辅料质量控制不严,影响产品质量。
三、抽检结果应用
药品抽检作为上市后药品监管的主要技术手段,在查控假劣药品、震慑不法企业,评价质量状况、服务药品监管,发现质量风险、消除安全隐患,提升药品质量、促进高质发展等方面发挥着不可替代的重要作用,是实现科学监管、智慧监管的重要技术支撑。2019年,药品监管部门充分利国家药品抽检结果,推进制度化规范化建设,不断提高抽检数据的深度挖掘和分析利用。
一是查控假劣药品。2019年,国家药监局组织各省级药品监管部门对国家药品抽检发现的所有不符合规定产品,在第一时间采取了查封扣押、暂停销售使用、要求企业主动召回等风险控制措施;对涉及的相关企业和单位均依法组织查处;同时要求药品生产企业认真排查,督促其查找问题原因并切实整改,确保质量安全隐患得到及时有效清除。通过药品抽检严厉打击了制售假劣药品的行为,发挥了震慑不法企业、净化市场环境的作用。此外,国家药监局在2019年共发布药品补充检验方法23个,为打假治劣提供了监管利器。
二是做好政策支撑。为配合国家医药新政执行,国家药品抽检加大了对国家基本药物、集中采购品种、进口药品等的抽检力度。2019年共抽检基本药物94个,较2018年增加了75个品种,且均为《国家基本药物目录(2018年版)》新增品种;对2019年“4+7”城市药品集中采购中选的25个品种进行了全覆盖抽检,抽取样品覆盖了全部集中采购中标企业;针对进口化学药品取消口岸通关检验的情况,开展对进口药品的抽检,并将抽样关口前移至口岸,全年共抽检进口药品(不含进口中药材)874批次,在为医药新政顺利实施提供有力技术支撑的同时,也保障了公众用药安全。
三是打击违法违规。2019年,药品监管部门深度利用法定标准检验与探索性研究结果等数据,挖掘可能的违法线索和潜在风险,及时开展现场检查化解系统性风险,根据检查结果采取相应的风险控制和监管措施,严厉打击个别企业存在的违法违规行为。例如,在检验中发现部分批次淡豆豉性状不符合规定,经检查发现个别企业质量把关不严甚至为了经济利益,将黑芸豆代替淡豆豉使用;在探索性研究中发现部分批次感冒止咳颗粒涉嫌违规投料,经检查发现个别企业涉嫌擅自变更工艺,采用提取物替代原粉投料。随着检验研究水平的不断提升,以及检验与检查工作的紧密结合,个别企业的侥幸心理和违法冲动得到遏制,质量安全意识逐步增强。
四是落实主体责任。2019年,对在探索性研究中发现的有关工艺、处方、原辅料、包装材料、说明书等方面可能存在的一般性问题,药品监管部门通过“药品质量提示函”等形式反馈相关企业,寓服务于监管。例如,对青霉胺片的探索性研究发现,包衣辅料中使用的着色剂氧化铁可能在一定程度上影响该药品吸收;对天麻追风膏的探索性研究发现,现有工艺可能会导致药品粘度过大、损料严重。各地监管部门围绕提示内容以及企业排查整改情况,采取多种方式加强对企业的指导和服务,督促企业不断完善质量保障体系,持续提高药品质量。
五是促进社会共治。2019年,国家药监局继续以通告的形式,及时发布不符合规定药品信息,全年共发布国家药品抽检通告8期;同时将全部通告信息纳入国家药监局政府网站数据库,供公众查询,警示公众用药安全。中检院持续在官方网站公开国家药品抽检的探索性研究情况,2019年共发布60个品种的新建检验方法、联系方式等内容,方便相关单位共享利用。2019年6月,中检院在成都召开一年一度的“药品质量安全年会”,年会依托国家药品抽检结果,分析药品质量状况,为药品检验机构、药品生产企业和研究机构搭建沟通交流平台。
六是推进制度建设。新修订的《中华人民共和国药品管理法》对药品抽检工作提出了新的也是更高的要求,面对药品监管的新形势、新任务、新要求,国家药监局在深入总结2013年以来药品抽检工作取得成绩和经验教训的基础上,广泛深入调研、充分听取社会各界意见,组织对药品抽检的制度体系进行重塑,分别于2019年8月和12月发布了《药品质量抽查检验管理办法》和《药品抽样原则及程序》,对药品抽检管理工作从制度上进行全方位革新,着力提高服务药品监管的效能,突出抽检工作的技术支撑作用,为全国药品抽检的顺利实施提供了有力的政策保障。
四、结语
2019年国家药品抽检工作顺利完成,抽检结果显示,当前我国药品质量处于较高水平,安全形势整体平稳可控。
当前,新型冠状病毒感染的肺炎疫情仍在持续,全国药品监管部门坚决落实党中央、国务院决策部署和国家药监局有关工作要求,切实把疫情防控作为当前工作的重中之重,重点加强了对疫情防控相关药品的抽检力度,严防问题产品流入市场造成危害。
2020年是全面建设小康社会的收官之年,国家药监局将继续落实问题导向和风险防控原则,不断完善国家药品抽检模式,不断提高发现问题、解决问题的能力,提高信息化管理水平,加强与检查、监测、稽查等工作的联动,继续为药品监管体系和监管能力现代化提供技术支撑,保障人民群众用药安全有效。
小贴士
1.药品抽检历史沿革
1956年,我国首次提出药品计划抽检的概念;1964年,原卫生部第一次制定国家级年度药品抽检计划并组织实施;1984年颁布《中华人民共和国药品管理法》,第一次从法律上明确了药品抽检工作的地位;1986年,实行药品质量公报制度;1990年,实行药品抽检收费制度,即抽检药品须由被抽检单位付检验费;2001年,《中华人民共和国药品管理法》修订,取消了药品抽检收费制度,所需费用由财政列支;2019年,《中华人民共和国药品管理法》再次修订,明确“药品监督管理部门根据监督管理的需要,可以对药品质量进行抽查检验”“抽样应当购买样品”。
2.药品标准检验
药品标准检验是指具有检验资质的药品检验机构,依据国家药品监督管理部门批准的法定检验标准中的检验方法,进行全项目或部分项目的检验,并依法出具检验报告书的过程。
3.探索性研究
探索性研究是指在国家药品抽检过程中,除按照国家药品标准进行检验并判定药品是否符合标准规定之外,针对可能存在的质量问题,应用该品种国家药品标准以外的检验项目和检测方法对药品质量进行进一步分析研究的过程。探索性研究结果不作为判定药品合格与否的依据,可为进一步提升药品质量水平、加强药品监管提供技术支持。
4.国家基本药物
基本药物是适应基本医疗卫生需求,剂型适宜,价格合理,能够保障供应,公众可公平获得的药品。国家基本药物目录是各级医疗卫生机构配备使用药品的依据。《国家基本药物目录(2018年版)》中的药品包括化学药品和生物制品、中成药、中药饮片3部分,其中,化学药品和生物制品主要依据临床药理学分类,共417个品种;中成药主要依据功能分类,共268个品种;中药饮片不列具体品种,颁布国家标准的中药饮片为国家基本药物,国家另有规定的除外。
5.药品补充检验方法
药品检验补充检验方法和检验项目(药品补充检验方法)适用于有掺杂、掺假嫌疑,且国家药品标准规定的检验方法和检验项目不能检验的药品检验。经国务院药品监督管理部门批准后,使用补充检验方法和检验项目所得出的检验结果,可以作为药品监督管理部门认定药品质量的依据。
6.检验项目
性状项下记载药品的外观、臭、味、溶解度以及物理常数等,在一定程度上反映药品的质量特性。
鉴别项下规定的试验方法,系根据反映该药品的某些物理、化学或生物学等特性所进行的药物鉴别试验,不完全代表对该药品化学结构的确认。
检查项下包括反映药品的安全性与有效性的试验方法和限度、均一性与纯度等制备工艺要求等内容;对于规定中的各种杂质检查项目,系指该药品在按既定工艺进行生产和正常贮藏过程中可能含有或产生并需控制的杂质(如残留溶剂、有关物质等);改变生产工艺时需另考虑增修订有关项目。
含量测定项下规定的试验方法,用于测定原料及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
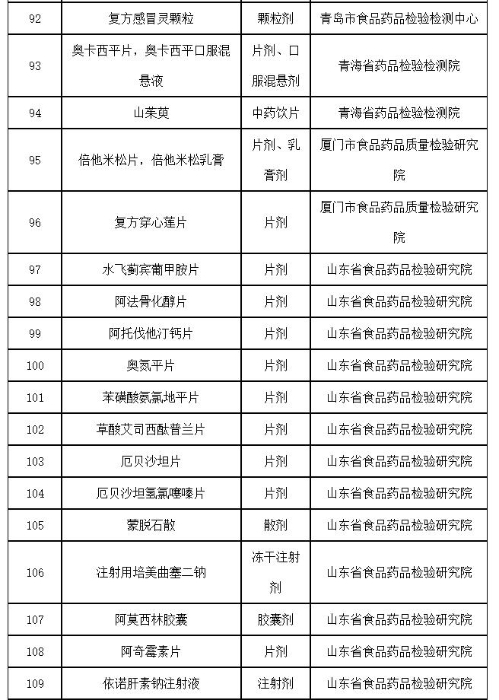
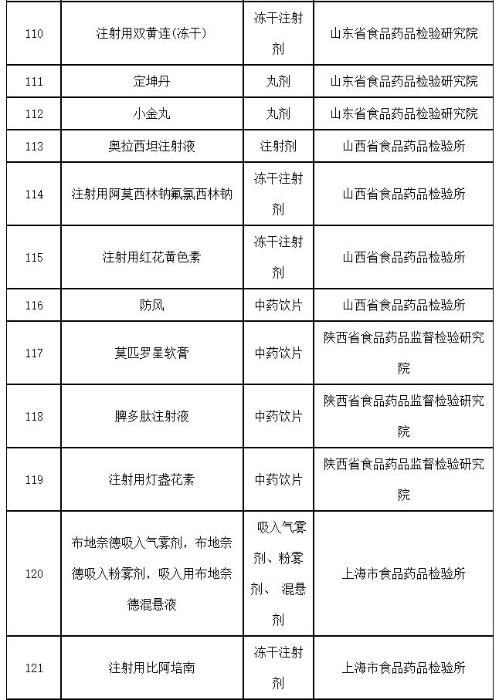
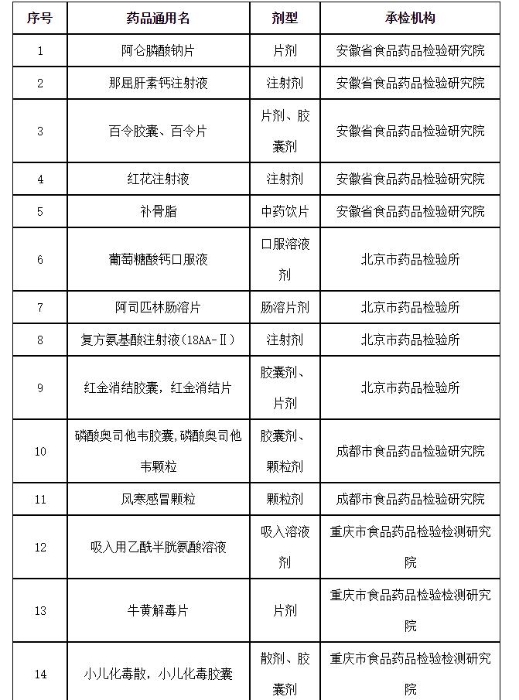
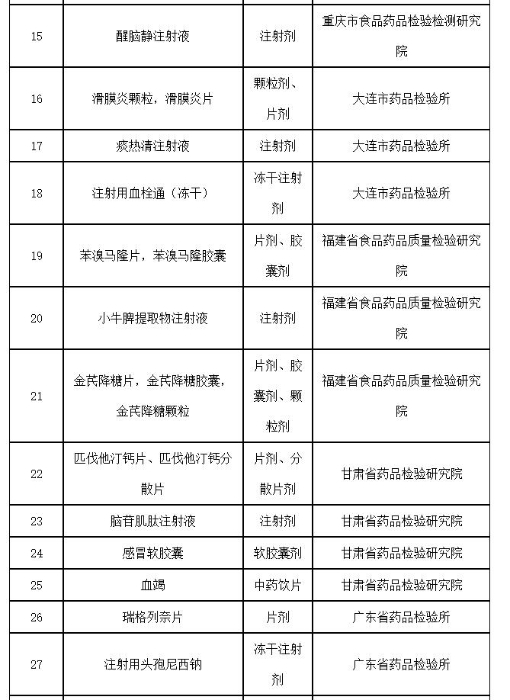
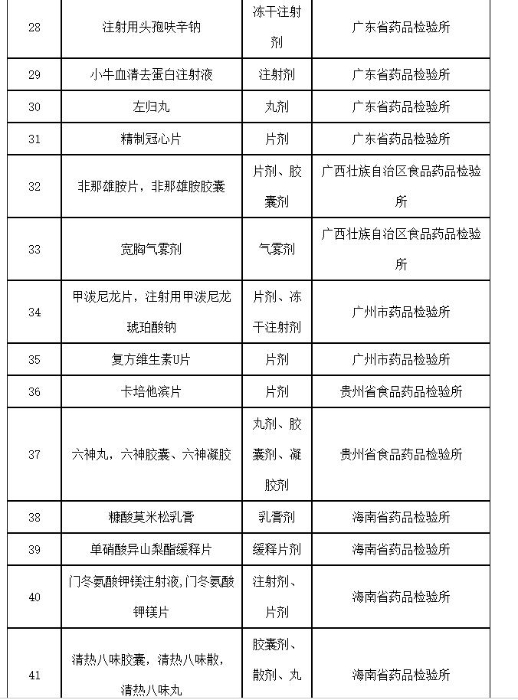
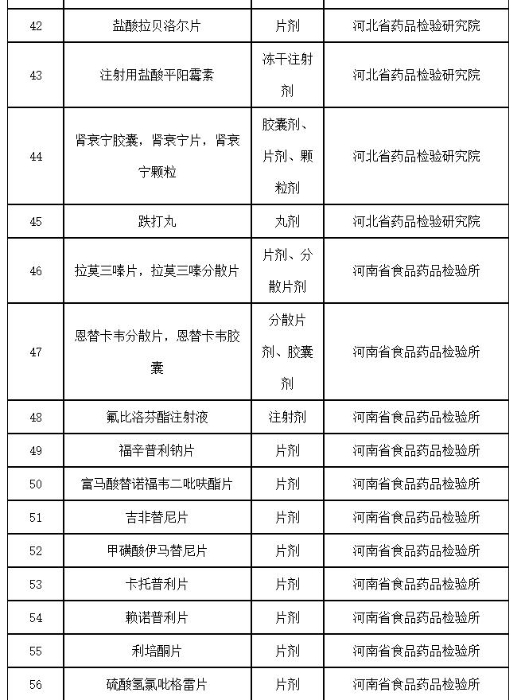
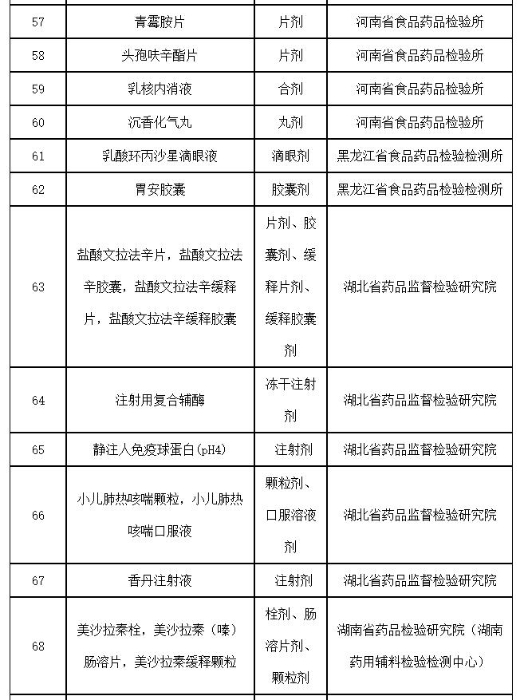
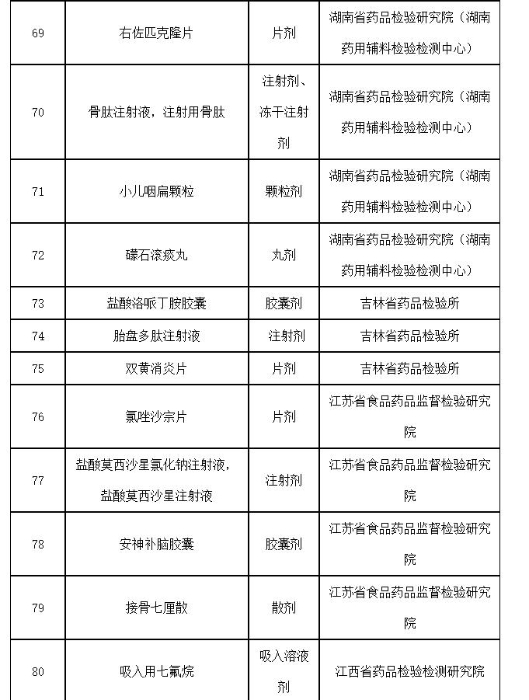
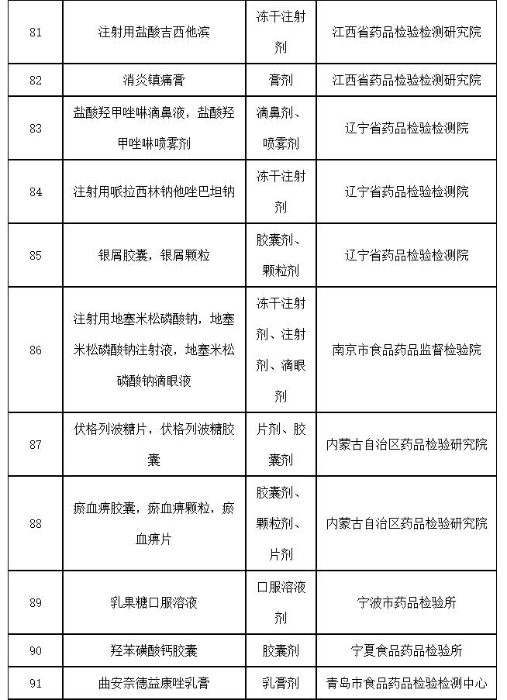
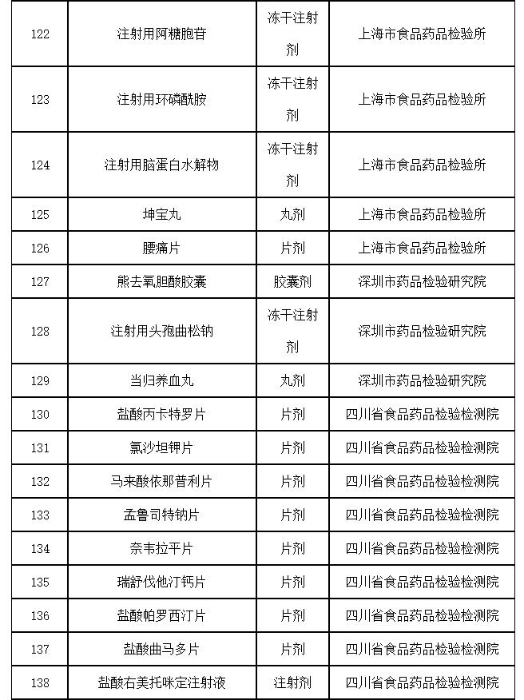
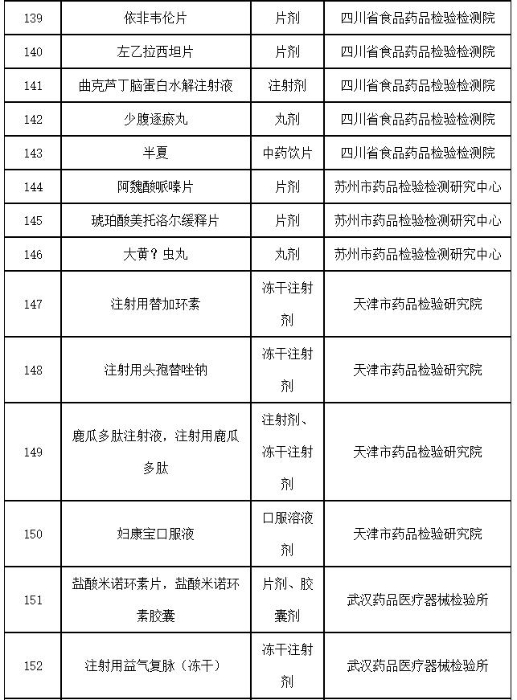
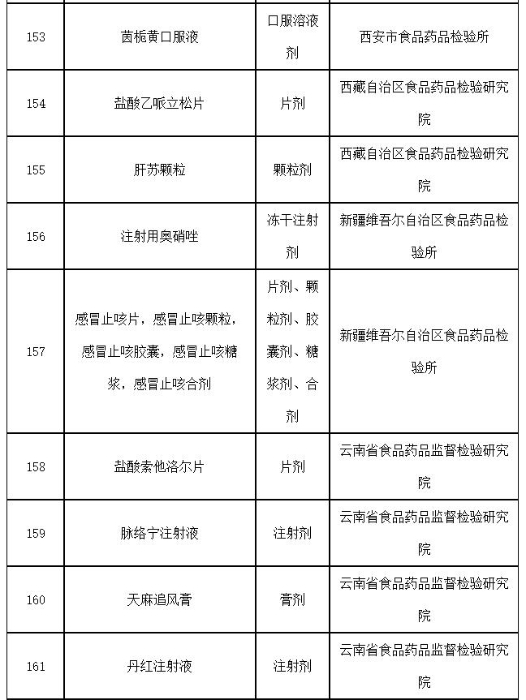
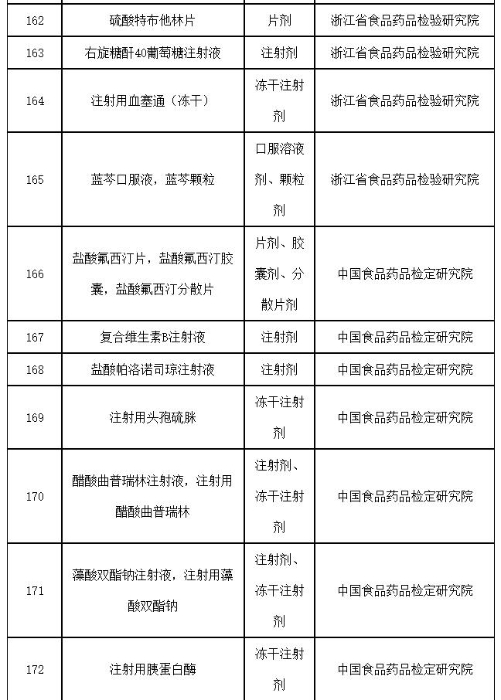
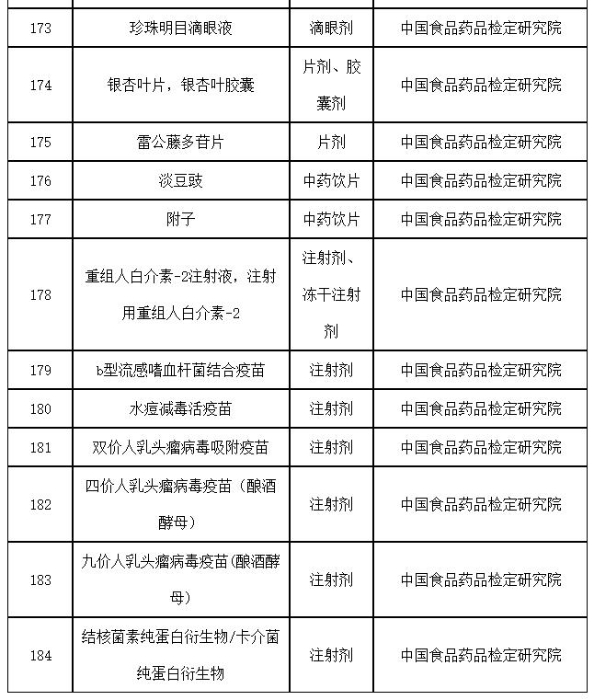
附件:2019年国家药品抽检品种目录
附件
2019年国家药品抽检品种目录
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:满雪)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
全国“两法”知识竞赛赛况(9月7日)
以上排行榜仅反映各省参赛人数和总分的实时情况。各省最终得分依据《国家药监局综合司关于开展全国“两法”知识竞赛活动的通知》中评分标准,由在线答题得分、监管人员参与度得分、药品企业从业... 2020-09-08 13:49 -

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有