中国肿瘤免疫领域成长迅猛,更多潜力靶点待深耕
- 2020-06-23 14:09
- 作者:麦倩衡
- 来源:科睿唯安
日前,在科睿唯安举办的“深度聚焦——中国的下一代肿瘤免疫研究”在线大讲堂上,科睿唯安生命科学与制药事业部大中华区首席科学家王刚博士,分析了国内研发格局及尚待发掘的靶点;江苏恒瑞医药股份有限公司副总经理兼首席医学官邹建军博士和复星凯特生物科技有限公司总裁王立群博士,分享了他们对于进一步把握联合用药及细胞治疗等新研发方向的见解。
全球肿瘤免疫领跑制药行业
王刚博士说:“从全球肿瘤免疫领域的发展现状来看,不管是研发管线、市场容量、专利申请,技术类型都持续增长,增长速度超越了全行业的平均发展速度。”
全球正在开发的活跃肿瘤免疫药物从2017年的2030款增加到3876款。这些药物分为6个大类,分别为T细胞靶向免疫调节剂、其他免疫调节剂、细胞疗法、肿瘤疫苗、溶瘤病毒和靶向CD3的双特异性抗体。细胞疗法在过去两年增长最快。
第一代肿瘤免疫药物2015年全球市场销售额为26亿美金。随着更多免疫检查点抑制剂的上市和适应证的拓展,其2019年市场销售猛增至240亿美金,并预计在2025年突破560亿美金。
在这样的利好环境下,肿瘤免疫的专利申请量在2000年至2018年间平稳攀升,同时有11%的专利布局多达15个国家以上,由此可见,专利申请方对于这一领域长期看好。从技术类型来看,特异性单克隆抗体靶向疗法和过继性细胞疗法增长最快。
对比中美两国在肿瘤免疫领域的表现,从专利成长趋势来看,近五年美国以69%的成长率领先全球,中国则以17%位居第二名,与美国仍有显著差距。其中,美国在癌症疫苗和细胞因子疗法领域的专利比例稳步上升,中国的专利增长则呈现在特异性单抗和细胞疗法领域。
中国研发管线竞争激烈,更多潜力靶点待深耕
国内肿瘤免疫研发最热门靶点首三名是CD19、PD-1和PD-L1,遥遥领先CD47、CD3、BCMA、CTLA-4、IL-2、CD22和CD20等其他靶点,研发格局尚欠多元化。
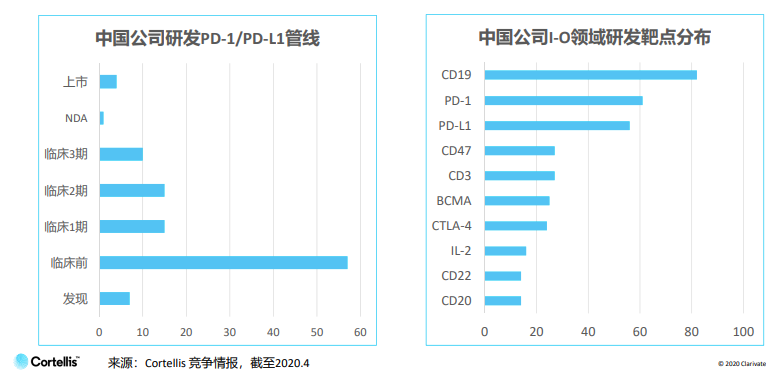
PD-1/PD-L1是国内最为人熟悉的靶点,除了8款已获批上市的药物外,还有近60个临床前项目。面对拥挤的赛道,中国企业积极寻找出路,比如研发基于PD-1的联合疗法、寻找被忽略的细分领域、及提高药物疗效、安全性和患者依从性等。
但放眼整个领域,仍有其他具有潜力的靶点值得深耕。分析全球超过3000个项目,科睿唯安寻找出18个尚无药物上市的热门靶点。
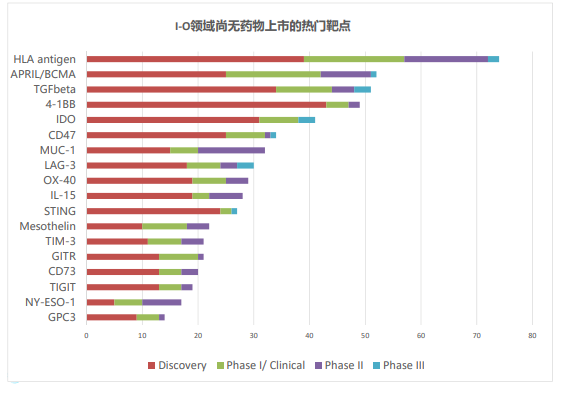
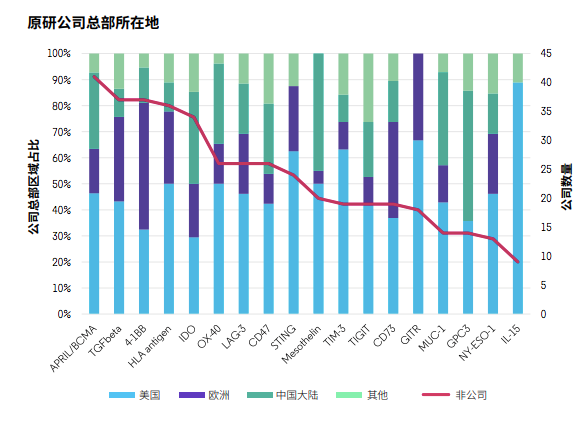
这些靶点分为三大类:T细胞靶点(抑制型:TIM-3,LAG-3,TIGIT;共刺激型:4-1BB,OX40,GITR)、其他免疫细胞靶点或肿瘤免疫微环境(CD73,IDO,IL-15,STING,TGF-β)和肿瘤细胞特异性或分化抗原(BCMA,CD47,GPC3,mesothelin,MUC-1,NY-ESO-1)。
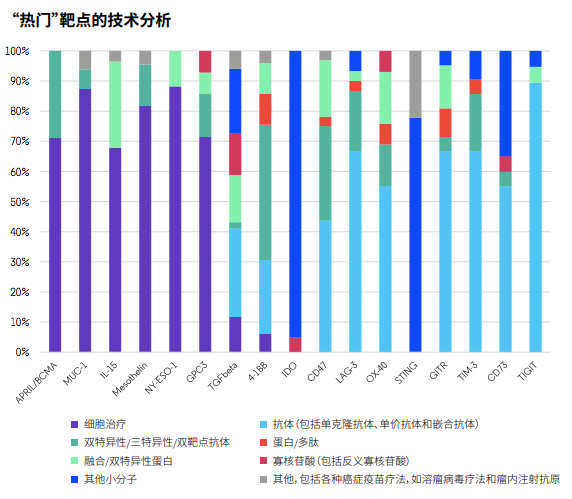
开发这些靶点虽能打开新市场,公司亦需制定出最可靠的路径。分析发现,针对T细胞靶点和CD47及CD73最多的疗法是抗体药物,而针对BCMA、MUC-1、IL‐15、mesothelin、NY-ESO-1和GPC3开发的疗法以细胞治疗为最常见。另外,以IDO和STING为靶点的开发主要以小分子抑制剂为主,同时也有靶向TGF-β的多种不同类型项目。
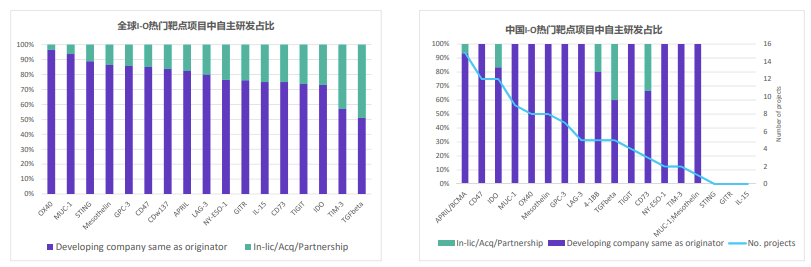
分析也发现,中国不论在靶点或技术类型方面都需要更加多元。
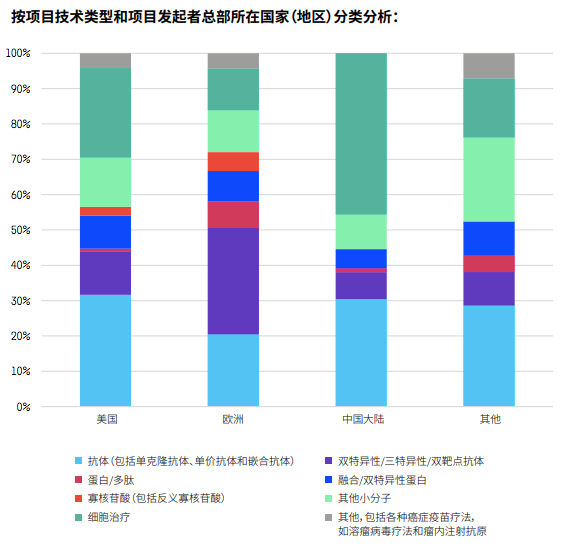
以领跑全球的美国为例,绝大多数靶点都有美国公司参与研发,占比超过30%。中国公司的参与度在某些靶点占比超过25%,比如BCMA、IDO、OX40、CD47、mesothelin、MUC‐1和GPC3,但很少有公司研究STING和GITR。而在分析项目技术类型时,也发现中国以细胞治疗为主,相对欠缺多元化。
研究水平紧追国际,积极布局下一代靶点
尽管如此,中国的肿瘤免疫领域继续活跃发展,并呈现几个特点。
中国公司强调自主研发,78%的热门靶点项目都是由发起该项目的同一家公司开发,仅7%来自合作。联合用药成为大趋势,所有靶点均联用PD1/L1抑制剂,另有一半联用CTLA-4。
从2013年到2019年,国内肿瘤免疫领域交易量增长7倍,而同期整个制药领域的交易量仅增长了4%。相比其他领域,美国公司在肿瘤免疫领域更愿意选择引进中国项目,而中国公司则倾向选择国内交易。
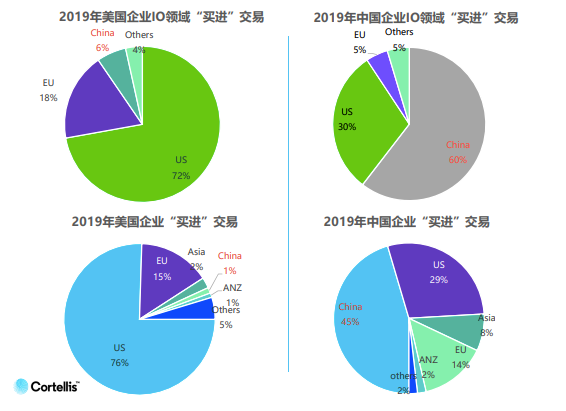
王刚博士说:“ 这说明了中国企业在肿瘤免疫领域选择国内交易的比例远高于全领域,同时也从侧面说明了中国整体在肿瘤免疫领域的研究水平与国际水平距离更加接近,差距比其他领域要小,因此交易发生的比例相对高于其他领域。”
强调创新的中国公司亦开展下一代的肿瘤免疫研究。从项目开发数量及阶段、海外临床试验进展、全球特殊资格认证方面,均见中国公司的积极布局。
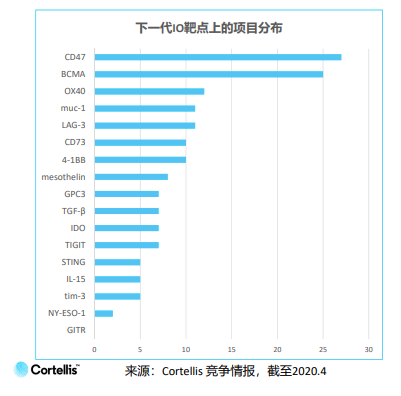
中国下一代的肿瘤免疫靶点项目占全部项目的27%,大多数仍在临床前阶段。热门的下一代靶点主要为CD47和BCMA,远高于其他靶点。
其中,15%的临床项目选择开展海外临床,集中在美国和澳大利亚,以临床1期和针对晚期实体瘤为主。百济神州和恒瑞各有两项海外临床项目,其他有布局的公司包括科济生物、天境生物和信达生物等。
值得一提的是,科济生物针对BCMA的候选CAR-T疗法CT-053获得FDA孤儿药和再生医学先进疗法(RMAT),以及EMA优先药物认定(PRIME)三项特殊资格。同样靶向BCMA,由南京传奇与杨森合作开发的LCAR‐B38M更获得四项特殊资格认定。
免疫2.0时代:联合用药、新辅助治疗、细胞治疗
王刚博士认为,开展药物联用和开发下一代的肿瘤免疫疗法,会是研究和投资的主要方向。他指出:“围绕PD-1/PD-L1为基础疗法的应用方案取得了非常多的突破,今年国家药监局授予罗氏的T+A(Tecentriq加Avastin)免疫联合疗法优先审评的资格,是一个药物联用的成功案例。”另外,随着对于相关机理的加深理解,他认为没有靶点会被判“死刑”。
邹建军博士表示,全球包括中国在内已进入“免疫2.0时代”,免疫治疗作为基础,联合化疗、放疗等标准治疗和抗血管生成药物等,比起单药使用在某些瘤种上疗效更显著。
因此,恒瑞除了推进其PD-1作为单药外,也在积极开发联合方案。在药物联用的策略上,邹建军博士提到结合临床疗效的循证医学的重要性。循证医学的证据显示免疫联合化疗和抗血管治疗有成效,使恒瑞决定作出这些尝试。
“目前各种联合方案都已经有非常丰富的理论基础,但其实肿瘤细胞的异质性非常强,肿瘤抑制的微环境常对单一疗法或不同联合疗法产生不一样的反应,抗肿瘤策略必须聚焦多个途径,才能充分激活内源性肿瘤免疫细胞,并使肿瘤免疫反应能够不断循环,方能打破治疗瓶颈。”邹建军说,公司其中一个方向是联合不同的免疫检查点抑制剂,致力于解决已接受过免疫治疗的病人出现复发和耐药的情况。
他表示,在单用或联合免疫治疗布局上,主要考虑从作用机制上的协同增效,此外是安全性,不希望能够带来协同增效的同时,大幅度提高安全性隐患。
邹建军认为,新辅助治疗会是未来免疫治疗的一个重要方向。早期的癌症病人免疫系统功能会较好,或能对免疫治疗产生更好反应。但如何在不耽误手术时机的前提下能达到最佳疗效,还有用药次数和时机等,仍有待验证。
细胞治疗也是下一代热门领域,但存在各种监管、技术和定价的挑战。王刚博士以Yescarta为例,指出对于个性化的创新治疗,各国的卫生技术评估时间和意见不同,仍有待观察监管机构会如何评估临床疗效和制造工艺。高昂的生产成本也带来高定价隐忧,药企需灵活平衡价格和患者可及性。
复星凯特专注于CAR-T治疗,王立群博士早就关注到CMC是特别关键的问题,他认为,工艺的设计必须顾及质量和实操性,有一个严谨并经过验证的工艺,才能保证最后成品的质量和属性满足安全性有效性。即使是同一个靶点,不一样的工艺也可使最终产品的质量和临床表现大相径庭。
“随着更多产品进入临床和商业化运营,在我们积累足够多的转化数据后,希望有更多重要参数进入T细胞产品体外评估,通过不同的维度,真正让我们做到有一定的预测性。”王立群说。
他同时指出了产业化和商业化面临的挑战,比如低温冷链的物流要求,提高平行生产能力,和无前例可循的注册检验程序等。他希望未来有更多资源投入肿瘤免疫领域,中国公司走出不同的途径、找到不同的靶点,更加多样化发展。
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐