药品注册收费标准出台,疫情防控药品、小微企业申请三类创新药均免注册费
- 2020-07-02 13:59
- 作者:陆悦
- 来源:中国食品药品网
中国食品药品网讯(记者陆悦) 6月30日,国家药监局公布《药品注册收费标准》《药品注册收费实施细则》,新收费标准自2020年7月1日起施行。7月1日前受理的药品注册申请,自标准实施之日起15个工作日内未按要求缴费的,终止药品注册程序。
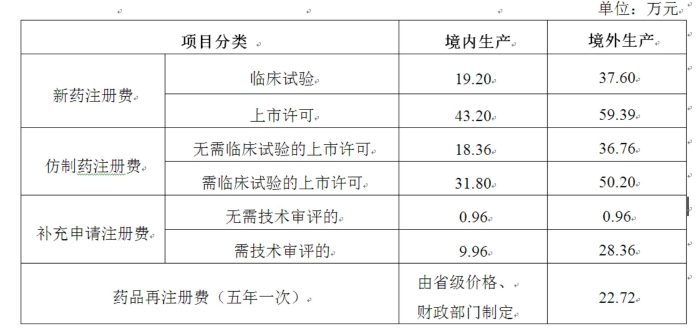
公告显示,国家药监局和省级药监部门依照法定职责,对药物临床试验申请、药品上市许可申请、补充申请和再注册申请开展行政受理、现场检查/核查、技术审评等注册工作,并按标准收取有关费用。对于境内生产的药品,新药注册费分为临床试验和上市许可两项,分别为19.2万元和43.2万元,总计62.4万元;仿制药申报上市,如无需临床试验,费用为18.36万元,如需临床试验费用则为31.8万元;补充申请注册,如无需技术审评,费用为0.96万元,如需技术审评费用则为9.96万元。境外生产的药品注册收费标准在境内相应收费标准基础上加收境内外检查交通费、住宿费和伙食费等差额。药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。
公告明确,根据《化学药品注册分类及申报资料要求》注册分类,1类、2类的化学药品按照新药注册费标准缴费,3类、4类、5类按照仿制药注册费标准缴费;根据《生物制品注册分类及申报资料要求》注册分类,所有类别的生物制品按照新药注册费标准缴费;根据《中药注册分类及申报资料要求》注册分类,中药创新药、中药改良型新药按照新药注册费标准缴费,古代经典名方中药复方制剂、同名同方药及其他类按照仿制药注册费标准缴费。
公告还明确,根据《关于新型冠状病毒感染的肺炎疫情防控期间免征部分行政事业性收费和政府性基金的公告》,在新冠肺炎疫情防控期间,对进入药品特别审批程序、治疗和预防新型冠状病毒感染肺炎的药品,免征药品注册费。对小微企业提出的三类创新药的注册申请,即:治疗艾滋病、恶性肿瘤,且未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其中药,未在国内外上市销售的通过合成或者半合成的方法制得的化学原料药及其制剂,治疗用生物制品注册分类1类和预防用生物制品注册分类1类,均免收新药注册费。
公告还对《药品注册管理办法》中属于备案/报告类变更的申请事项,申请一次性进口药品,注册加急,港、澳、台药品注册,化学原料药注册申请,药械组合产品注册等多种情况的收费标准进行了明确。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
为你推荐
-

-












