药物警戒 | 我国与欧洲、美国、日本药物警戒制度的比较
- 2020-07-09 13:58
- 作者:
- 来源:天津市药物临床研究技术创新中心
药物警戒是与发现、评估、理解和预防各种不良反应或与其他任何可能的药物问题有关的科学研究和活动。药物警戒的目的是为了降低药品风险,实现药品风险-获益平衡,给患者带来最大化的益处。药物警戒的研究对象是在药品正常使用的情况下出现的有害反应以及其他与药品安全相关的问题,主体内容是药品不良反应报告和围绕药品全生命周期的其他药品安全监管活动。
目前,我国药物警戒制度建设仍在探索阶段,可以借鉴先进的药物警戒理念与方法,完善本国的药物警戒理念和制度。本文将我国与欧洲、美国和日本的药物警戒制度进行比较,通过法律框架、主要文件内容和机构设置方面的比较,剖析我国药物警戒制度现状,为其进一步发展提出建议。
法律框架
中国自1998年开始建立药品不良反应监测与报告制度,鼓励企业自主报告不良反应。2019年新修订的《药品管理法》,正式将药物警戒制度立法。药物警戒相关法律法规的不断颁布,意味着我国对药物警戒工作的重视。
1965年1月,欧盟理事会颁布第65/65/EEC号指令,标志欧盟药事立法的开始。而美国药物警戒制度体系分为法律、法规和指南文件三个层面。2014 年 11 月,日本出台《药品和医疗器械法》( Pharmaceutical and Medical Device Act,PMD Act)取代之前的《药事法》,成为确保药品、医疗器械等质量可控性、有效性和安全性的现行法律。
中国、欧洲、美国和日本的药物警戒制度相关的主要文件见表1。
表1. 中国、欧洲、美国和日本的药物警戒制度相关的主要文件
主要文件内容
中国
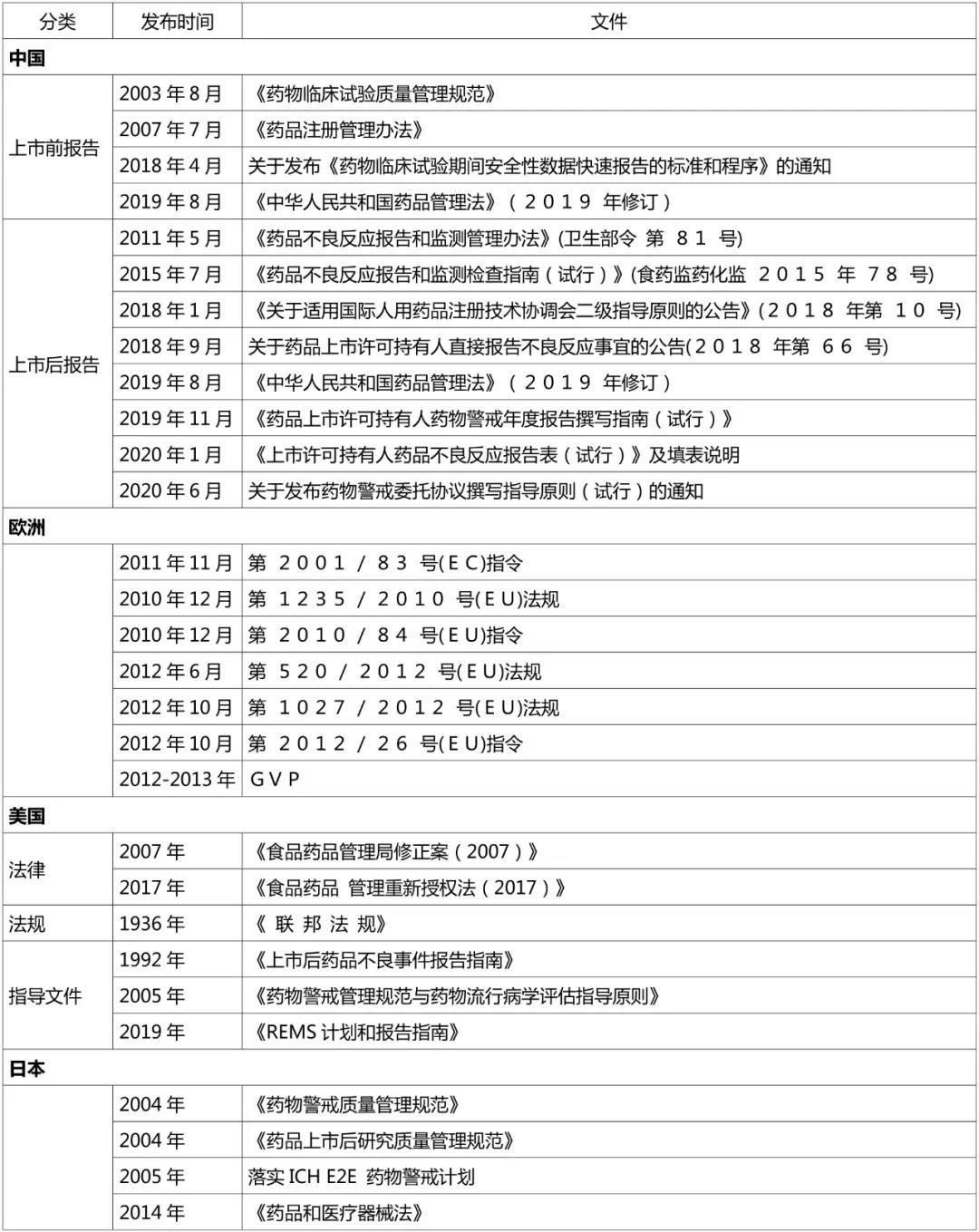
表2. 中国药物警戒制度相关的主要文件和内容
欧洲
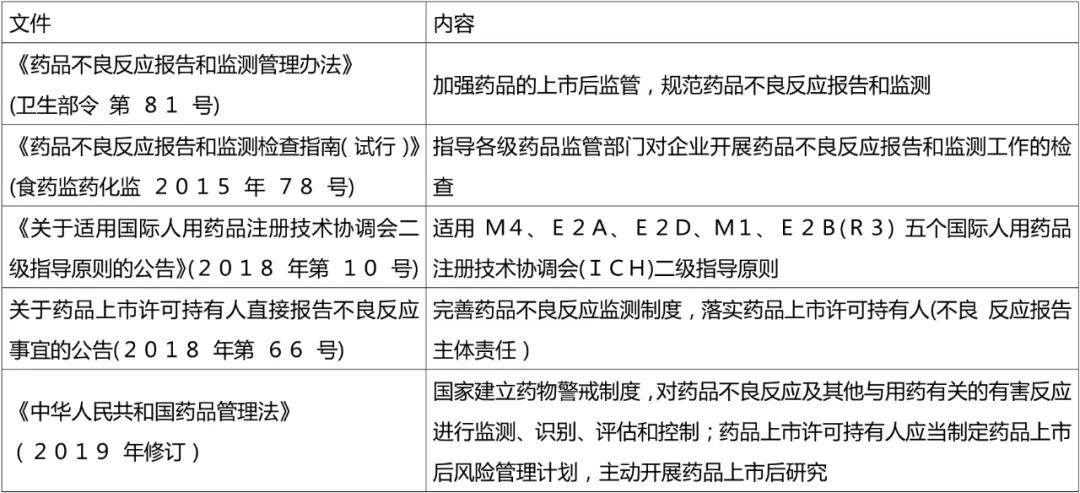
表3. 欧洲药物警戒制度相关的主要文件和内容
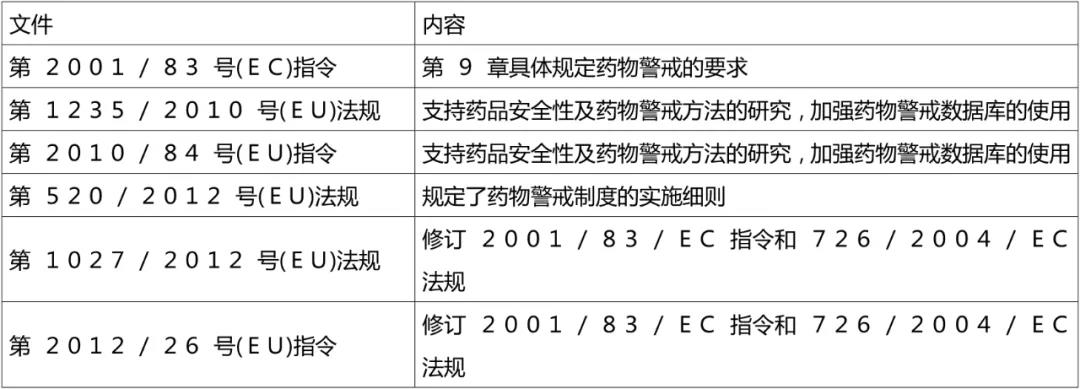
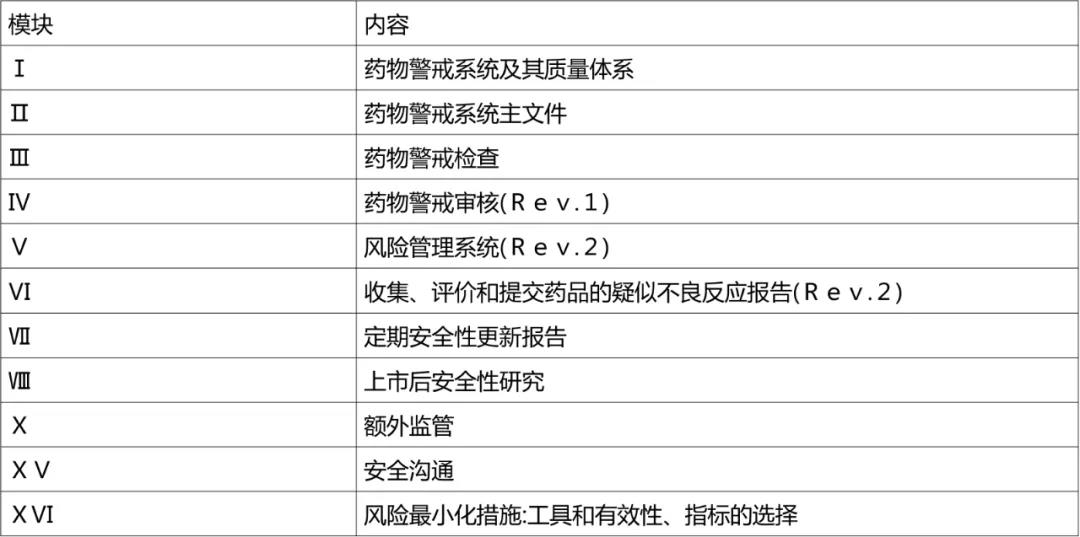
2012年,欧盟制定了《药物警戒实践指南》(GVP),为药物警戒工作的开展提供了一整套的指南。欧盟药物警戒制度立法的主要文件见表。GVP共包括11个模块涵盖药物警戒的主要方面,见表4。
表4. 欧盟GVP模块介绍
美国
美国《联邦法规》(Code of Federal Regulations, CFR)第21章从药物警戒的执行层面予以细化,上市前研究用药安全性报告的相应法规收录在21 CFR312 中,上市后药品安全性报告的相应法规主要收录在21CFR314中。
表5. 美国CFR中适用药物警戒的条款
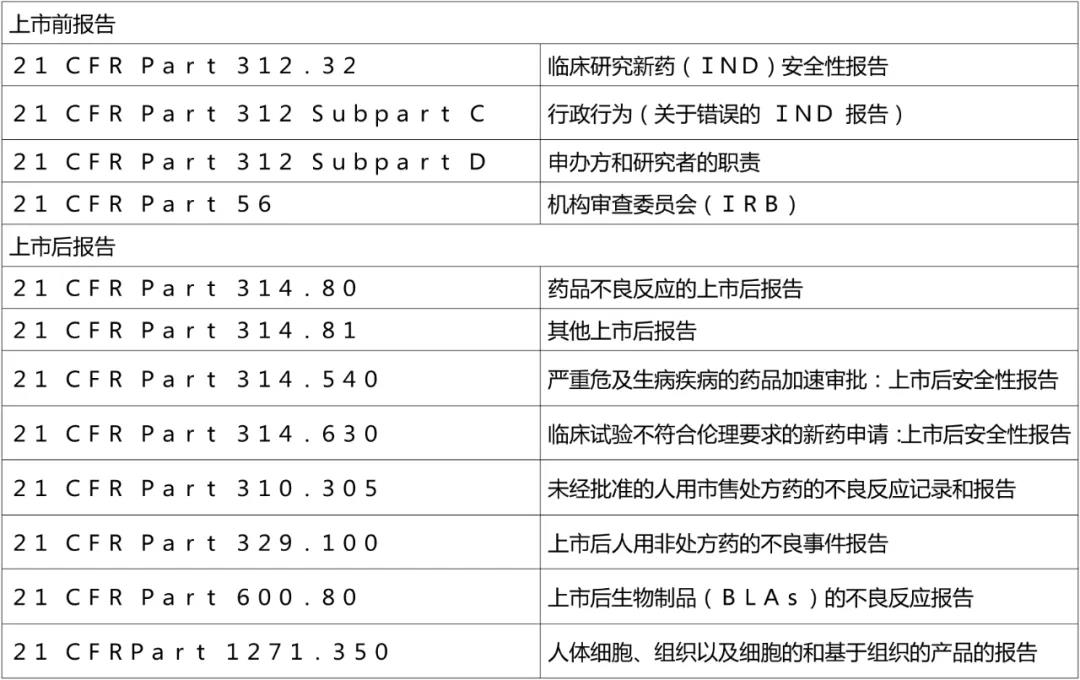
日本
表6. 日本药物警戒制度相关的主要文件和内容
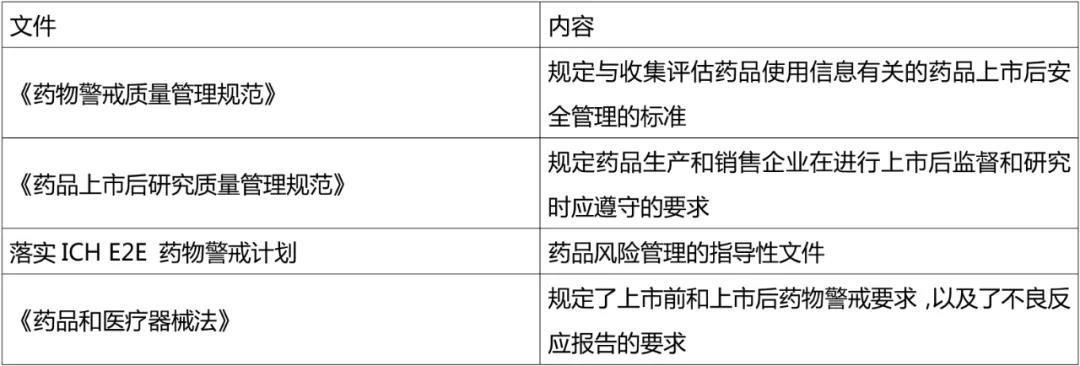
机构设置
我国药物警戒的组织机构可分为行政组织和技术组织两部分。行政组织即国家药品监督管理局和地方药品监督管理局; 技术组织即国家药品监督管理局药品评价中心(国家药品不良反应监测中心)、 省级药品不良反应监测中心等,形成了从国家到县级的四级药品不良反应监测中心(图1)。
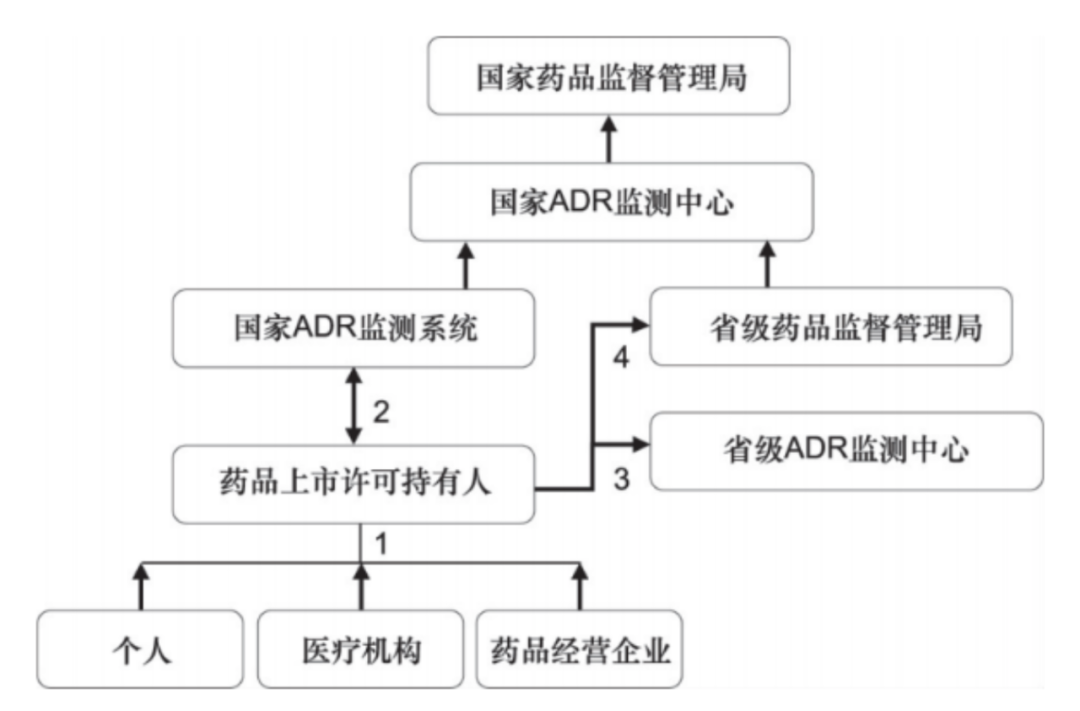
图1 我国药物警戒活动的组织机构
欧盟的药物警戒工作机构是药物警戒风险评估委员会(PRAC)。2010年,欧洲药品管理局(European Medicines Agency, EMA)为加强欧洲药品的安全性监测,根据药物警戒立法正式成立了PRAC。美国主要负责药物警戒工作的机构为FDA的药品审评与研究中心(Centre for Evaluation and Research, CDER)。CDER的监测与流行病学办公室(Office of Surveillance and Epidemiology, OSE)扮演关键的药物警戒角色,负责评估药品在整个生命周期中的安全性。在日本,承担药物警戒工作的机构包括厚生劳动省 (Ministry of Health, Labour and Welfare, MHLW) 及其下属机构:医药生活卫生局(Pharma- ceutical Safety and Environmental Health Bureau, PSEHB)和独立行政法人医药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency, PMDA) 。
对我国药物警戒制度建设的建议
建立健全的药物警戒法律法规,完善配套文件;
形成覆盖药品全生命周期的药物警戒制度;
加强我国药物警戒组织机构的沟通协作;
完善我国药物警戒数据库,加强数据分析、预警功能和公开访问权限等设置的技术支持;
推进落实我国风险管理计划,加快实施ICH E2E;
加强药品不良反应主动监测,识别风险信号,弥补被动监测的不足。(天津市药物临床研究技术创新中心)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

以律为舟,谋定而后动—— 医药企业出海新兴市场的九大考量
全球医药市场格局正在重塑,我国医药企业依托创新积淀与成本优势,正以前所未有的规模和速度扬帆出海。全球新兴市场的巨大增量空间、资本青睐的国际合作契机,为我国医药企业出海开辟了价值跃升... 2026-01-27 09:10 -

依案说法|实际销售软件产品与注册证信息不一致,如何处罚?
2025年12月,A市药监部门依据《条例》第八十六条规定,对B公司生产经营与实际注册信息不符产品的行为,作出没收违法所得,并处罚款;并责令立即停止销售涉案产品,对已销售产品实施召回的处罚决... 2026-01-27 09:05
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









