中美欧药品注册对照谈 | 中美欧药物临床试验申请有何不同?
- 2020-09-18 18:34
- 作者:徐娜
- 来源:中国食品药品网
按照新修订《药品注册管理办法》(以下简称新《办法》),我国对药物临床试验申请,实行默示许可制度。那么,对于药物临床试验申请,我国与美国和欧盟的相关制度相比有何区别呢?笔者为您一一介绍。
中国临床试验申请
药物临床试验(IND)分为Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期临床试验以及生物等效性试验。根据药物特点和研究目的,研究内容包括临床药理学研究、探索性临床试验、确证性临床试验和上市后研究。
根据新《办法》第二十三、二十四、二十五和二十六条规定,申请人完成支持药物临床试验的药学和药理毒理学等研究后,提出药物临床试验申请的,应当按照申报资料要求提交相关研究资料。国家药监局药品审评中心(以下简称药审中心)在五个工作日内完成形式审查,申报资料符合要求的,予以受理,并组织药学、医学和其他技术人员对已受理的药物临床试验申请进行审评,受理之日起六十日内决定是否同意开展临床试验,并通知申请人审批结果;逾期未通知的,视为同意,经伦理委员会审查同意,申请人可以按照提交的方案开展药物临床试验。
临床试验开始前申请人应在“药物临床试验登记与信息公示平台”进行临床试验相关信息登记。
美国临床试验申请
IND的申请可涵盖一期或多期临床试验。依据21CFR312,FDA对申请人提供的药学、非临床研究、临床研究资料等进行审核,以判断药品是否可以安全进入人体试验阶段。如果提交的材料无缺陷,FDA须在收到申请之后30天内予以回复,否则自动进入临床试验阶段。
FDA根据新药申请需求,将IND分为获得上市许可的商业性IND和研究性(非商业)IND。非商业性IND的申请,又可根据其研究目的分为研究者IND、紧急使用IND以及治疗IND。
对符合要求的临床试验,在临床试验开始后的21天内,申请人须按要求登录ClinicalTrial.gov,登记临床试验相关信息。
欧盟临床试验申请
欧盟的临床试验申请称为CTA(Clinical Trial Application)。2001年4月,欧盟颁布第一部完整的人用药品临床试验相关法规2001/20/EC。2014年4月16日,人用药品临床试验法规 (EU)No 536/2014取代指令2001/20/EC用于临床试验监管。(EU)No 536/2014的主要特点体现在监管理念的提高,以及申请程序的简化:通过专门的网站提交CTA申请、提交一套申报资料、设立一体化的审评程序、提高临床试验过程及结果的透明度、从整体上对欧盟成员国的临床试验申请进行管理。目前,欧盟临床试验申请门户网站和数据库未上线,CTIS(Clinical Trials Information System)建议上线时间为2021年12月,具体信息以官方网站通知为准。
(EU)No 536/2014根据临床研究目的,将CTA分为三类:用于支持药品上市申请的临床研究、上市后临床研究、研究者发起的科研性临床研究。新法规规定CTA申请须同时经过科学和伦理审查后方可实施临床试验,对审批时限也进行明确规定,即申请的正常审评时限为:初次申请60天,生物制品及先进疗法药物比其他药品临床试验申请额外延长50天;正常审评最长审批时限为105天,若为生物制品或先进性疗法则为156天。
中美欧药物临床试验申请分析
我国仅对以药品上市为目的的临床试验有审批要求,对其他非商业目的的临床试验没有明确要求;而欧美对商业性临床试验申请和非商业性的临床研究都进行了要求。建议我国药物临床试验相关法规明确适用范围和定义,以加强对非上市为目的药物临床试验的监管。
与我国IND默示许可制(自受理之日起60工作日内)和欧盟新法规实施后的常规审评审批时长(60日历日,最长105日历日)相比,FDA IND默示许可制(30个日历日)效率更高。对于临床试验申请申报资料的技术要求,我国相对较多,特别是证明性文件的准备,对企业来说是比较大的挑战。从鼓励创新和同一药品鼓励全球同步开发的角度出发,笔者期待我国可以放宽对申报资料内容细节和证明性文件的要求,比如临床试验申请阶段是否需要提供大量原始图谱,是否需要提供批检验记录和批生产记录,是否可以取消证明性文件原件的要求等。
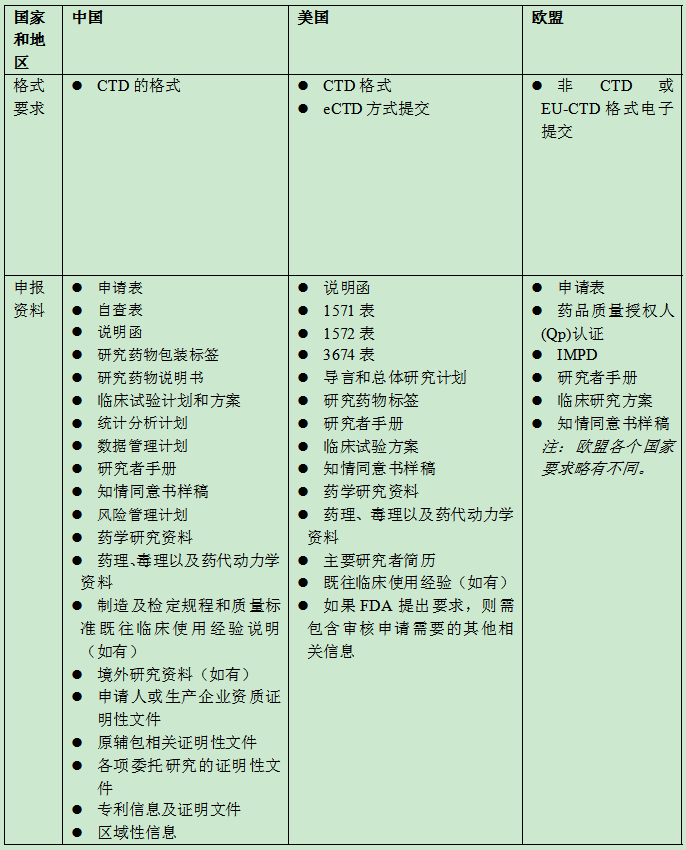
笔者根据现行法规,制作主要申报资料清单对比表(参见表1),可供参考。
新《办法》实施后,中国IND阶段审评是基于风险启动药品注册核查、检验,与以前逢审必查的审评模式相比,大大提高了审评效率。美国和欧盟在临床试验申请阶段对核查和检验没有要求。(徐娜 DIA中国药品法规事务社区核心成员)
表1:临床试验申请(IND/CTA)主要申报资料参考清单
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













