加强临床试验数据管理,严处数据造假行为
- 2021-02-19 14:51
- 作者:王海燕
- 来源:中国食品药品网
药物临床试验数据是药物临床试验申办方向药品监管机构递交的重要审评资料。真实、规范、完整的临床试验数据,是药品安全性和有效性的源头保障。自2015年药品审评审批制度改革至今,药品监管部门不断加强药物临床试验数据核查力度,发布一系列指导原则,严处临床试验数据造假行为,为药品全生命周期监管工作提供有力保障。
启动“史上最严”药物临床试验数据核查
2015年8月出台的《国务院关于改革药品医疗器械审评审批制度的意见》(以下简称《意见》)明确提出,加强临床试验全过程监管,确保临床试验数据真实可靠。申请人、研究机构在注册申请中,如存在报送虚假研制方法、质量标准、药理及毒理试验数据、临床试验结果等情况,对其药品医疗器械注册申请不予批准,已批准的予以撤销;对直接责任人依法从严处罚,对出具虚假试验结果的研究机构取消相关试验资格,处罚结果向社会公布。
根据《意见》有关要求,针对部分药品注册申请中临床试验数据不真实甚至弄虚作假问题,2015年7月22日,原国家食品药品监督管理总局发布《关于开展药物临床试验数据自查核查工作的公告》(以下简称《核查公告》),组织对已申报生产或进口的待审药品开展临床试验数据核查工作,标志着我国“史上最严”的临床试验数据核查全面启动。
基于《核查公告》,2015年8月19日,原国家食品药品监督管理总局发布《关于进一步做好药物临床试验数据自查核查工作有关事宜的公告》,明确药物临床试验申请人和药品注册申请人对临床试验数据真实性承担全部法律责任。申请人自查发现临床试验数据存在不真实、不完整的问题,可以主动撤回注册申请;明确临床试验数据真实性核查工作首先在进入审评程序的药品注册申请中进行;要求申请人、药物临床试验机构、生物样本分析测试中心等单位须主动配合检查人员的现场核查;鼓励公众举报申请人、合同研究组织、临床试验机构弄虚作假的情形。
2015年9月9日,《关于药物临床试验机构和合同研究组织开展临床试验情况的公告》发布,公布自查资料中涉及的临床试验机构和CRO情况,并提出开展临床试验数据核查工作。
表1. 自查资料中涉及的临床试验机构和CRO情况
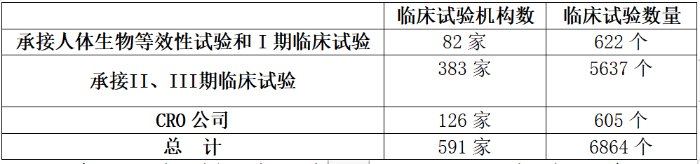
(数据来源:《关于药物临床试验机构和合同研究组织开展临床试验情况的公告》)
2015年9月24日,原国家食品药品监督管理总局等部门联合发布《关于开展药物临床试验机构自查的公告》,明确药物临床试验机构应主动开展临床试验数据自查工作,按照《核查公告》,配合药品注册申请人做好临床试验数据自查工作,梳理所承担临床试验的品种,结合自查情况以及既往药物临床试验机构监督检查结果,对本机构药物临床试验数据的真实性、完整性作出评价;加强对药物临床试验的管理,对药物临床试验弄虚作假的,严厉追究责任。
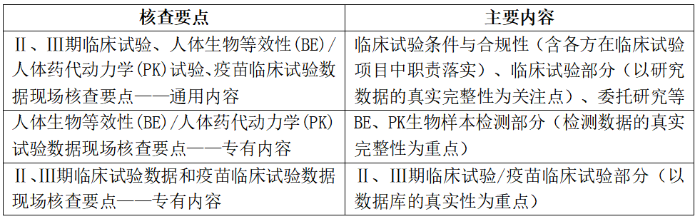
2015年11月10日,原国家食品药品监督管理总局发布《药物临床试验数据现场核查要点》(以下简称《核查要点》),规范药物临床试验数据现场核查。根据《核查要点》,要求对完成自查资料填报的药品注册申请逐一进行临床试验数据现场核查。临床试验机构或临床试验合同研究组织按照《核查要点》,对试验数据的真实性、完整性进行自查,发现存在不真实问题的,应主动将情况报告国家药监部门,并督促申请人主动撤回申请。
表2. 《药物临床试验数据现场核查要点》主要内容
针对各省级药监部门在自查核查工作中存在的问题,2015年12月17日,原国家食品药品监督管理总局发布《关于进一步加强药物临床试验数据自查核查的通知》,明确了省级药监部门在核查中发现药物临床试验数据存在不真实、不完整等问题的责任;要求各省级药监部门应当按照《核查要点》,对《核查公告》所列注册申请中仍待审评审批项目的药物临床试验数据重新组织核查,各省级药监部门应当组织属地药物临床试验机构对所承担的《核查公告》及其后所有注册申请的药物临床试验进行自查;针对数据不真实和不规范、不完整问题,分别采取相应处罚措施;明确申请人、研究者和合同研究组织以及省局在确保药物临床试验数据真实性、完整性中的责任分工;并将各地履行现场核查职责的情况纳入对地方政府食品药品监管工作的年度考核等内容。
为加强药物临床试验数据核查工作组织管理,保障药物临床试验数据核查质量和效率,2016年3月29日,原国家食品药品监督管理总局发布《药物临床试验数据核查工作程序(暂行)》,明确药物临床试验数据现场核查通知、实施以及核查后的处理等工作程序。
《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》发布后,2017年5月18日,原国家食品药品监督管理总局制定发布《仿制药质量和疗效一致性评价临床试验数据核查指导原则》,规范仿制药质量和疗效一致性评价临床试验数据核查要求,为生物等效性试验、临床有效性试验等临床试验数据开展核查,确认临床试验数据真实性、规范性和完整性提供技术指导。
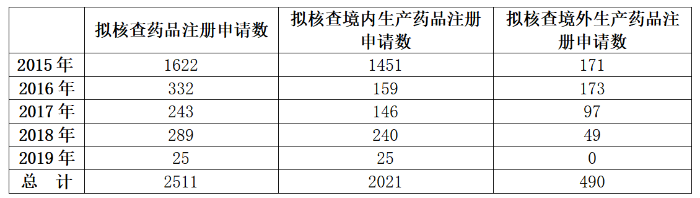
2015年至2019年,国家药监部门共发布19期关于药物临床试验数据自查核查注册申请情况的公告,拟对收到的已完成临床试验申报生产或进口的共计2511个药品注册申请进行药物临床试验数据核查。公告中同时明确,在国家药监部门组织核查前,药品注册申请人自查发现药物临床试验数据存在真实性问题的,可主动撤回注册申请,国家药监部门公布名单,不予追究责任;食品药品审核查验中心在网站公示现场核查计划,并告知药品注册申请人及其所在地省级药品监管部门,公示10个工作日后食品药品审核查验中心将通知现场核查日期,不再接收药品注册申请人的撤回申请。
表3.2015~2019年国家药监部门公布收到的已完成临床试验申报生产或进口药品注册申请拟进行药物临床试验数据核查情况
(数据来源:2015~2019年,原国家食品药品监督管理总局/国家药品监督管理局官网发布的各期关于药物临床试验数据自查核查注册申请情况的公告汇总)
发布技术指导原则,规范和指导药物临床试验数据管理工作
2016年7月29日,原国家食品药品监督管理总局发布《临床试验数据管理工作技术指南》,从数据管理相关人员的职责、资质和培训,管理系统的要求,试验数据的标准化,数据管理工作的主要内容,数据质量的保障和评估,以及安全性数据及严重不良事件等6个方面进行全面阐释,规范和指导我国临床试验数据管理工作。该技术指南的发布,填补了我国药物临床试验数据管理缺乏配套技术指导原则的空白,对改变临床试验数据管理质量良莠不齐的局面,具有非常重要的意义。同时,原国家食品药品监督管理总局还发布了《药物临床试验数据管理与统计分析的计划和报告指导原则》,为数据管理工作和统计学分析原则制定详细的计划书提供技术指导。
新修订《药品管理法》和《药品注册管理办法》实施后,为规范药品注册申请人递交药物临床试验数据及相关资料,提高药品审评效率,配合新修订的药品注册申报资料要求,2020年7月20日,国家药监局药审中心(CDE)发布《药物临床试验数据递交指导原则(试行)》,对临床试验数据递交的内容及格式提出具体要求,指导申办方规范递交临床试验数据及相关资料。
此外,2020年10月16日,CDE制定发布了《药物临床试验数据监查委员会指导原则(试行)》,主要阐述药物临床试验数据监查委员会在临床试验中的职责、任务和组成等,为申办者提供监查委员会建立与实施的指导性建议,确保监查委员会规范运作和顺利实施,促进受试者权益保护和临床试验数据的可靠性。
严厉打击数据造假行为
2017年10月,中办、国办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,明确严肃查处数据造假行为;明确临床试验委托协议签署人和临床试验研究者是临床试验数据的第一责任人,须对临床试验数据可靠性承担法律责任。
新修订《药品管理法》第一百二十三条和《药品注册管理办法》第一百一十一条均对提供虚假数据需承担的法律责任作出明确规定:在药品注册过程中,提供虚假的证明、数据、资料、样品或者采取其他手段骗取临床试验许可或者药品注册等许可的,撤销相关许可,十年内不受理其相应申请,并处五十万元以上五百万元以下的罚款;情节严重的,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,处二万元以上二十万元以下的罚款,十年内禁止从事药品生产经营活动,并可以由公安机关处五日以上十五日以下的拘留。
即将于今年3月1日实施的《刑法修正案(十一)》与《药品管理法》进行了有效衔接。第一百四十二条规定,违反药品管理法规,药品申请注册中提供虚假的证明、数据、资料、样品或者采取其他欺骗手段的,足以严重危害人体健康的,处三年以下有期徒刑或者拘役,并处或者单处罚金;对人体健康造成严重危害或者有其他严重情节的,处三年以上七年以下有期徒刑,并处罚金。(王海燕)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

以律为舟,谋定而后动—— 医药企业出海新兴市场的九大考量
全球医药市场格局正在重塑,我国医药企业依托创新积淀与成本优势,正以前所未有的规模和速度扬帆出海。全球新兴市场的巨大增量空间、资本青睐的国际合作契机,为我国医药企业出海开辟了价值跃升... 2026-01-27 09:10 -

依案说法|实际销售软件产品与注册证信息不一致,如何处罚?
2025年12月,A市药监部门依据《条例》第八十六条规定,对B公司生产经营与实际注册信息不符产品的行为,作出没收违法所得,并处罚款;并责令立即停止销售涉案产品,对已销售产品实施召回的处罚决... 2026-01-27 09:05
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有