他山之石 | 专用体外诊断医疗器械标签上标志符号的使用
- 2021-02-22 14:56
- 作者:
- 来源:中国食品药品网
IVDs 的市场是国际化的。欧盟(EU)成员国试图通过欧盟的体外诊断医疗器械指令(指令 98/79 / EC,以下简称 IVD 指令)协调体外诊断医疗器械的国家立法。IVD 指令在 2003 年 12 月 8 日全面生效,自生效日起,欧盟成员国国内销售的 IVDs 必须符合IVD 指令且具有 CE 标志(表示待售产品通过欧盟认证)以表示满足要求。
欧盟的 IVD 指令和 FDA 21 CFR 809.10 和 21 CFR 610 部分、660部分的法规都要求 IVDs 本身或者其标签上应标有重要信息。IVD指令明确指出每个欧盟成员国可以要求这些信息以其本国家的语言来表述,因此同一个体外诊断医疗器械的标签上可能会有多种语言,以便在欧盟范围内销售。另外,IVD 指令鼓励使用统一的标准符号代替文字来传达所需信息。鉴于不同成员国可能要求使用不同的语言,且大多数 IVDs 及其包装都很小,IVD 指令对标志符号的规定代表了一个大趋势,制造商可由此实现在国际市场的合规性。
同样,标志符号的使用可以帮助 IVDs 的制造商在美国和欧盟(和任何允许使用这些国际标准符号的其他国家)市场上创建统一的标签,而不需要为每个市场制定单独的标签。由于符号比文本占用更少的空间,因此使用标志符号可使 IVDs 的标签不过于拥挤且更清晰。使用标志符号的另外一个优势是,当使用单一标签(而不是为美国市场设置一种标签,为欧盟市场设置另一种标签)时错误率会降低。当然,至关重要一点的是符号传达的内容必须与文字表达的含义一致且能够被广泛理解。
法律方面的考虑
FDA 法规中 21 CFR 809.10 和 21 C FR 610、660 部分规定了美国市场上销售的 IVDs 的标签需要包括的信息内容。这些规定指明了标签上应包括的内容和信息以及描述这些信息的先后顺序。除了少数例外,这些规定并没有限制制造商必须使用同一的文字表述来满足要求。
FD&C 法案 502(c)部分中,“如果有任何词语、语句或其他FD&C 法案要求的信息未在标签上突出显示 (相比于标签上其他词句,或其他医疗器械的标签设计),而这些语句可使在通常条件下购买和使用的普通个人容易阅读和理解”,则此药物或医疗器械被判定为错贴标签。因此,21 CFR 809.10 和 21 CFR 的 610、660 部分要求的信息也必须满足 FD&C 法案 502 (c)部分的需求。
对于法规中要求的用于传达信息的标志符号,必须是一个“术语”,也就是“普通个人在通常条件下购买和使用时容易阅读和理解的”的语言。本指南统一了两个国际标准中 FDA 认为可以满足需求的标志符号,因此依照 FD&C 法案 514 (c),FDA 将认可在 IVDs 标签上使用特定符号 (见 2003 年 4 月 28 日发布的联邦公报(68 FR 22391); 2003 年 10 月 28 日纠正了其中的认可范围(68FR 61448))。在这种背景下,我们将“普通用户”定义为狭义上的 IVDs 专业用户。“通常的购买和使用条件”是指在实验室环境中。根据 FD&C 法案 514(c),通过对国际共识标准的认可过程,FDA 收到了在美国进行的用户理解研究的结果,证明了目标受众可以理解本指南中所说的在标签上替代文字使用的 25 种符号。
这些标志符号的使用也可以帮助满足 502 (c)中“显而易见”的要求。正如上面所说,大多数 IVDs 体积小,贴标签的空间有限。用符号代替一些文本语句,制造商可提高标签的易读性,从而可以更好突出所需 “突出”的信息。对这些标准符号识别度进行的研究报告也表明,参与者大力支持用符号代替文本。
本指南文件认为,通过共识标准认可过程确定的标准符号已经提交至 FDA 并被 FDA 接受,依照 21 CFR 809.10 和 21 CFR 610、660. 部分的要求,这些符号可能被作为与 IVDs 专业用户进行交流的术语,制造商有责任修订标签使其符合这些规定和 FD&C 法案及其他法规的要求。
如上所述,21 CFR 809.10 和 21 CFR 660 部分的一些规定指明了特定的标签语言。基于执法自由裁量权,FDA 将不反对以下符号的使用。
●按照 21 CFR 809.10(a)(4)、809.10(b)(5)(ii)、660.28(b)(13)和 660.55(b)(10)的要求,包装盒上用字母组成符号“IVD”来代替文字描述“供体外诊断使用”。
●用代表“仅供体外诊断医疗器械疗效评估”的符号代替文字声明“仅供临床实验使用,其性能尚未确立”。由于在 21 CFR809.10(c)(2)( ii)中 FDA 将这个符号等同于此声明,本符号仅限于满足此要求的体外诊断医疗器械。临床实验或研究现状有关的标签受其他法规限制的体外诊断医疗器械,如 21 CFR 812.5(a), 809.10(c)(2)(i)或 312.6(a)的要求,必须仍具有其他法规中要求的文字性陈述,不应该具有本符号。
表示“欧共体授权代表”的符号不需要履行 21 CFR 809.10 或 21CFR 中 610 及 660 部分的要求,因为美国规定不需要提供这些信息。IVDs 制造商为了满足欧洲市场对标签的要求,一般希望此符号可以在美国和欧盟都可以使用。因此,只要不违反美国对标签的其他规定,制造商可以在美国使用此符号。例如,如果美国市场上的 IVDs 贴了“欧盟授权代表”符号,并且这一符号干扰了美国法律要求的信息沟通,那么该设备可能按 FD&C 法案 502 (c)规定被视为错贴标签。
FDA 认可的 ISO 15223 和 EN 980 中的某些医疗器械标志符号
依照 FD&C 法案 514(c)建立的共识标准认可过程,在 2003 年4 月 28 日发布的联邦公报(68 FR 22391)中,FDA 发布公告认可了某些用于上市前审评的标准,其中包括了下面列出的两个有关符号标识使用的标准。在 2003 年 10 月 28 日修订的联邦公报(68FR61448)中,FDA 发布公告纠正了 4 月 28 日版联邦公布中认可的两个标准的范围。FDA 在以下两个国际公认标准中将 25 个符号认定为专用 IVDs 的标识符号。
● ISO 15223,医疗器械——医疗器械标签使用符号和应提供的信息
● EN 980,用于医疗器械标签的图形符号
图 8-1 中列出了各符号的含义。
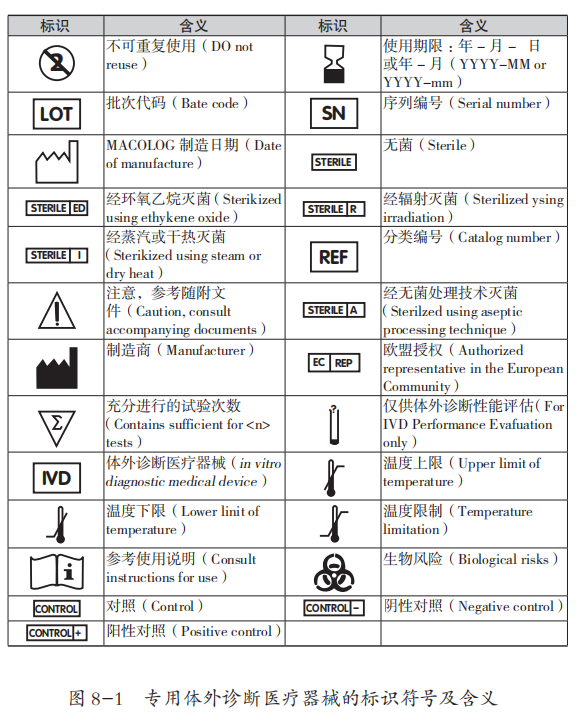
FDA 通过共识标准认可程序得出的验证数据显示体外诊断医疗器械的专业用户,也就是这个标签的目标受众能够理解上述 25 个符号。具体来说,在美国实施的,由具有不同教育背景的专业实验室测试用户参加的研究表明,在有相关术语以及其他方法提示的语境下,这些符号能够被终端用户理解。
体外诊断医疗器械的标签
FDA 认为这些符号只适用于体外诊断医疗器械的标签。这种认定证明了 FDA 与国际标准制定组织共同协调监管工作的努力。这种认定是由研究的范围和结果所支持的,并且这一研究已经提交给了 FDA。FDA 尚未收到支持在 IVDs 标签上使用任何其他符号以及在其他医疗器械的标签上使用这些符号的研究报告,其他医疗器械指的是普通用户和购买使用条件不同于 IVDs 的其他医疗器械。
专用标签
FDA 认可的这些符号仅在 IVDs 的专用标签上使用。FDA 并不认可将这些符号使用在非处方或处方类家用 IVDs 的标签上。通过FDA 的共识标准认可过程得到的验证数据,支持在 IVDs 专用标签上使用符号,而非在消费者标签上使用。
术语表
FDA 建议每个体外诊断医疗器械都有术语表来定义在设备标签上使用的符号。无论是否用于该设备,这个术语表可能还包含被FDA 认可的 ISO 15223 和 EN 980 中的其他符号标识。术语表可使用户熟悉符号的含义,当用户不能回忆某符号的含义时也可作为查找参考。术语表也有助于满足 FD&C 法案 502(c)条款的要求,确保在通常使用条件下,IVDs 用户能获得必要的参考资料,尽可能使他们可以理解符号。由于用户随手可得 IVDs 的说明书,FDA鼓励在说明书中加入术语表。当 IVDs 的标签更新或修订时,术语表很可能只是一张单独的纸或卡片,但为确保便于获得,FDA建议符号的术语表还是应作为说明书的一部分。
教育宣传
FDA 建议制造商对目标受众进行教育宣传,以提高其对新引入符号的理解。教育宣传应针对各种 IVDs 的专业用户(如实验室技术人员、护士、实验室助理、医疗助理)。FDA 建议可以通过以下方法来进行教育:
●印刷性材料,如实验室出版的术语表、挂图、文章 ;
●行业网站上的信息 ;
●医疗服务人员的投稿 ;
●专业杂志上的广告 ;
●培训课程。
教育宣传应该延伸到该体外诊断医疗器械的流通链中的所有人,如批发商和分销商,他们需要知道有关有效期和储存条件相关的符号。
这些教育宣传方案通过为 IVDs 用户建立了一个可理解所使用符号的环境,从而能够满足 FD&C 法案 502(c)条款是要求。FDA 建议制造商评估教育宣传活动,以确定这些活动是否有效地使 IVDs 用户理解符号的意义。
其他符号的应用指南
CDRH 将考虑通过 FDA 的共识标准的认可过程,认可其他符号使用在 IVDs 的标签中。关于这个过程的更多信息,请参考 FDA 的相关网页 :http ://www.fda.gov/cdrh/stdsprog.html。
实施
对于 FDA 已批准上市前批准申请的专用 IVDs,制造商可在上市前申请的补充申请未批准的情况下对标签进行变更,用 FDA 认可的符号来代替文本内容。按照 21 CFR 814.39(b)的要求,其他标签变更可能需要提交新的上市前申请。根据 21 CFR 814.84,上市前申请持有人在实施这类变更时应在上市前申请的下一年度报告中通知相关机构。同样,根据 21 CFR 601.12(f)(3)(A),生物医疗器械许可证持有人实施这类变更时应该在下一年度生物医疗器械许可申请的年度报告中通知相关机构,相关机构将考虑这些变更是属于重要变更还是微小变更。对于售前通知(PremarketNotification,510(k))已被许可的 IVDs,制造商可直接用被认可的符号代替专用 IVDs 现行标签上等同的文本,而不需要提交新的售前通知。(其他标签的信息更改可能需要提交新的 510(k)时, 请 参 见 21 CFR 807.81(a)(3) 和 FDA 的 指 导 文 件,“ 现有设备变更何时提交 510(k),”,网址 http ://www.fda.gov/cdrh/ode/510kmod.pdf)
根据 21 CFR 803 部分的要求,制造商和进口商应当向 FDA 报告在专用 IVDs 标签中使用符号时出现的任何不良事件。报告形式和指导可在以下网址中获得 :http ://www.fda.gov/medwatch/safety.html。【摘编自《FDA药品与生物制品管理办法指南(二)》,中国医药科技出版社】
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









