盘点 | 2021年1月全球获批的新药
- 2021-02-23 20:27
- 作者:章成 梁家康
- 来源:火石创造
2021年1月,全球批准新药数量有所下降,美国FDA共完成69项药品首次批准(不包含临时批准),其中有4个药物是新获批的新分子实体。欧洲药品管理局共批准8个新药上市,包含新活性物质4个。我国新批准药品均为仿制药,其中杭州和泽坤元的普瑞巴林口服溶液和恒瑞医药的盐酸右美托咪定氯化钠注射液均为国内首仿品种,仿制药一致性评价工作稳定开展,注射剂型通过一致性评价数量创新高。
全球药品获批情况
美国FDA批准情况

图1 2010—2021年FDA药物批准数量变化情况
数据来源:美国食品药品监督管理局
如图1,截至2021年2月5日,美国FDA官网披露,2021年1月FDA共完成69项药品首次批准(不包含临时批准),其中包括NDA/BLA 6个(不包含暂批药物),4个药物是新获批的新分子实体。
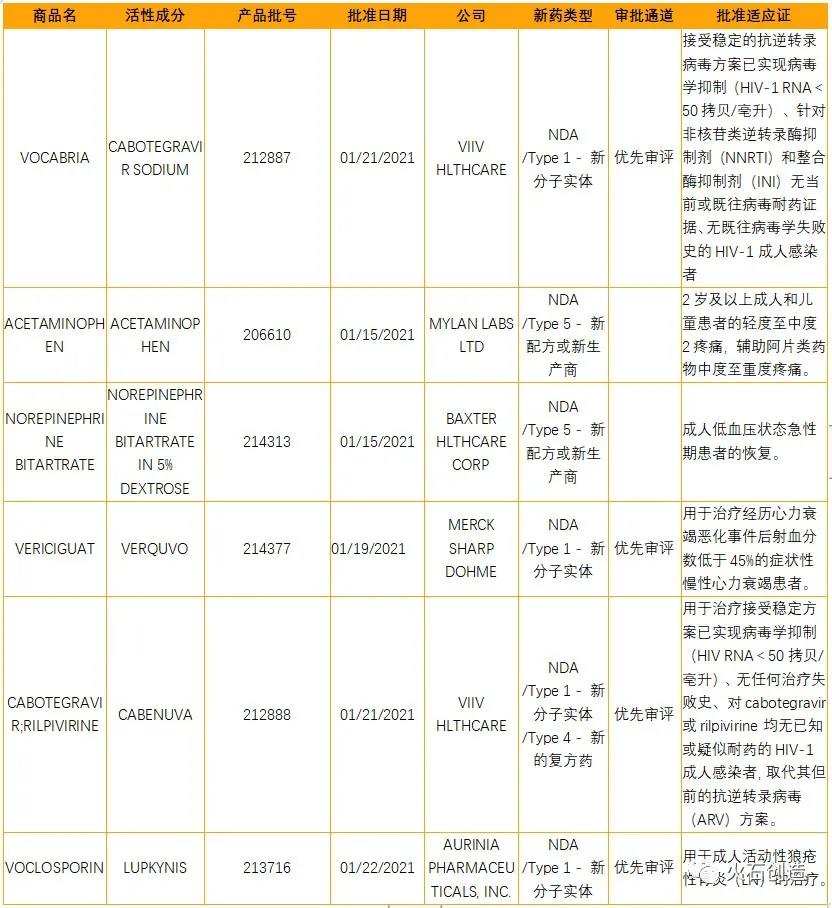
表1 2021年1月FDA批准NDA/BLA药物列表
数据来源:美国食品药品监督管理局
欧盟EMA批准情况
截至2021年2月5日EMA官网披露,2021年1月EMA批准上市药品共计4个,其中新活性物质(New active substance,NAS)3个。
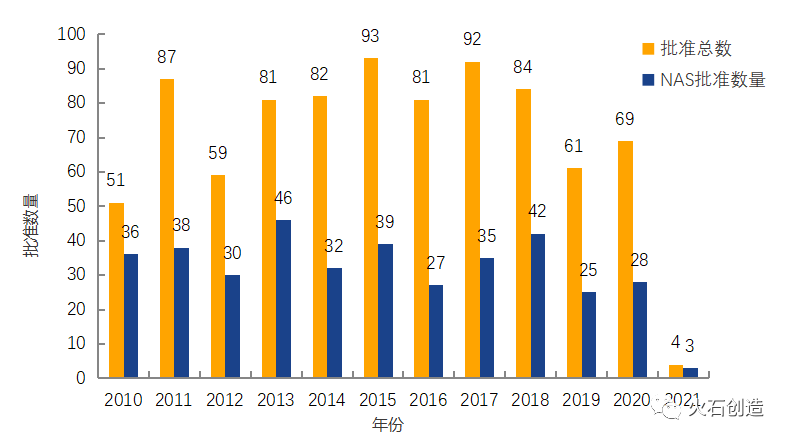
图2 2010—2021年EMA药物批准数量变化情况
数据来源:欧洲药品管理局
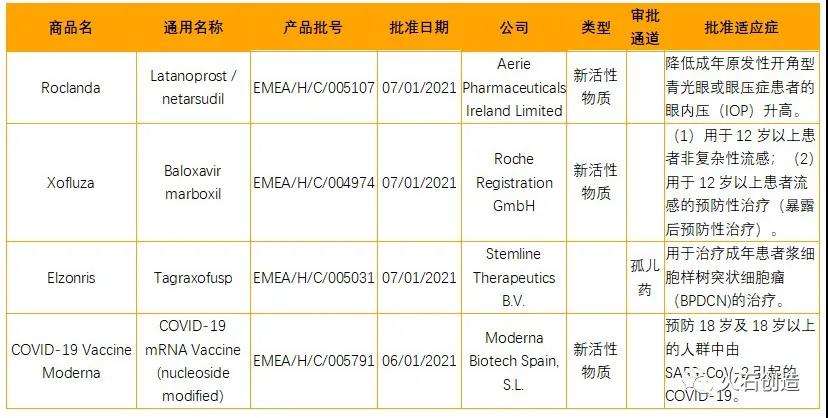
表2 2021年1月EMA批准的药物列表
数据来源:欧洲药品管理局
国家药监局批准情况
截至2021年2月5日国家药监局披露,2021年1月共批准国产首次注册药品37件。按剂型去重后,共24个药品品种,其中杭州和泽坤元的普瑞巴林口服溶液和恒瑞医药的盐酸右美托咪定氯化钠注射液均为国内首仿品种。
普瑞巴林原研厂家为美国辉瑞,口服溶液及胶囊剂型于2004年12月获美国FDA批准上市,该药于2010年7月获批进入中国,获批适应症为带状疱疹后疼痛的治疗。该药自全球上市以来,是神经镇痛领域的重磅药物。
普瑞巴林于2019年6月结束市场独占期,随后各厂商纷纷开始仿制。CDE官网数据显示,目前国内申请普瑞巴林原料药及制剂企业众多,其中普瑞巴林胶囊由重庆赛维拿下首仿,齐鲁制药、华润双鹤和美诺华在上市销售中,正在上市申请的企业多达18家。此外,济川药业、江西青峰、广东众生以及山东郎诺也已提交普瑞巴林口服溶液剂型的仿制申请。该药于2017年进入国家医保目录,2019年国内销售额为4亿元,其中原研辉瑞生产的普瑞巴林目前占据大约7成市场,随着国内仿制药纷纷上市,降价成为必然。
仿制药一致性评价情况
截至2021年2月5日,CDE共承办2753个仿制药一致性评价受理号,1月新增110个获承办受理号。截至2021年1月5日,共2016个品规上市药品通过一致性评价(包含视同通过914个品规),本月共191个品规药品通过一致性评价(包含视同通过91个品规),按剂型去重后,共91个药品品种,其中38个品规的药品为首家过评。本月过评药品中共计82个品规的注射剂型,注射剂型一致性评价通过数量再创新高,其中盐酸右美咪托定注射液7家企业过评,注射用帕瑞昔布4家企业过评,随着第四批集采中注射剂型数量增多,注射剂型的一致性评价成为企业竞争的热点。
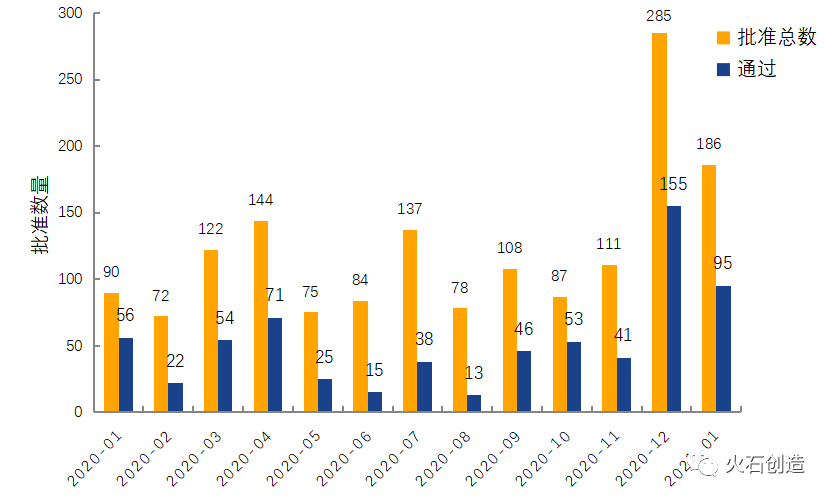
图3 2020年仿制药一致性评价批准数量变化情况
数据来源:国家药品监督管理总局
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












