新法规下药品上市许可及技术权属转让(上)——内容、权利和义务
- 2021-03-04 16:08
- 作者:邓勇 朱谢君
- 来源:中国食品药品网
新《药品管理法》已于2019年12月1日起正式施行,其中对药品上市许可及技术权属转让作出了新的规定。
《药品管理法》中与药品上市许可持有人(MAH)制度相关的规定共计近40条,对药品质量、生产经营、不良反应监测等问题作出了较为全面的规定,第六条将MAH制度确定为药品基本管理制度,第四十条规定:“经国务院药品监督管理部门批准,药品上市许可持有人可以转让药品上市许可。受让方应当具备保障药品安全性、有效性和质量可控性的质量管理、风险防控和责任赔偿等能力,履行药品上市许可持有人义务。”新《药品管理法》实施之前我国对药品市场准入实行批准文号管理制度,批准文号只发给药品生产企业,研发机构只能通过兴建厂房自行生产或转让技术两种方式获利;新法规定表明MAH可以自己生产药品或者转让给他人加工生产药品,在满足特定条件的情况下转让药品上市许可及技术权属是可行的,药品上市与生产许可相分离,药品技术转让属于纯粹的交易活动,无需审批,这一规定对促进资源合理配置、加速科研成果商业化意义重大。
下表为部分试点省市MAH制度实施方案及特点:
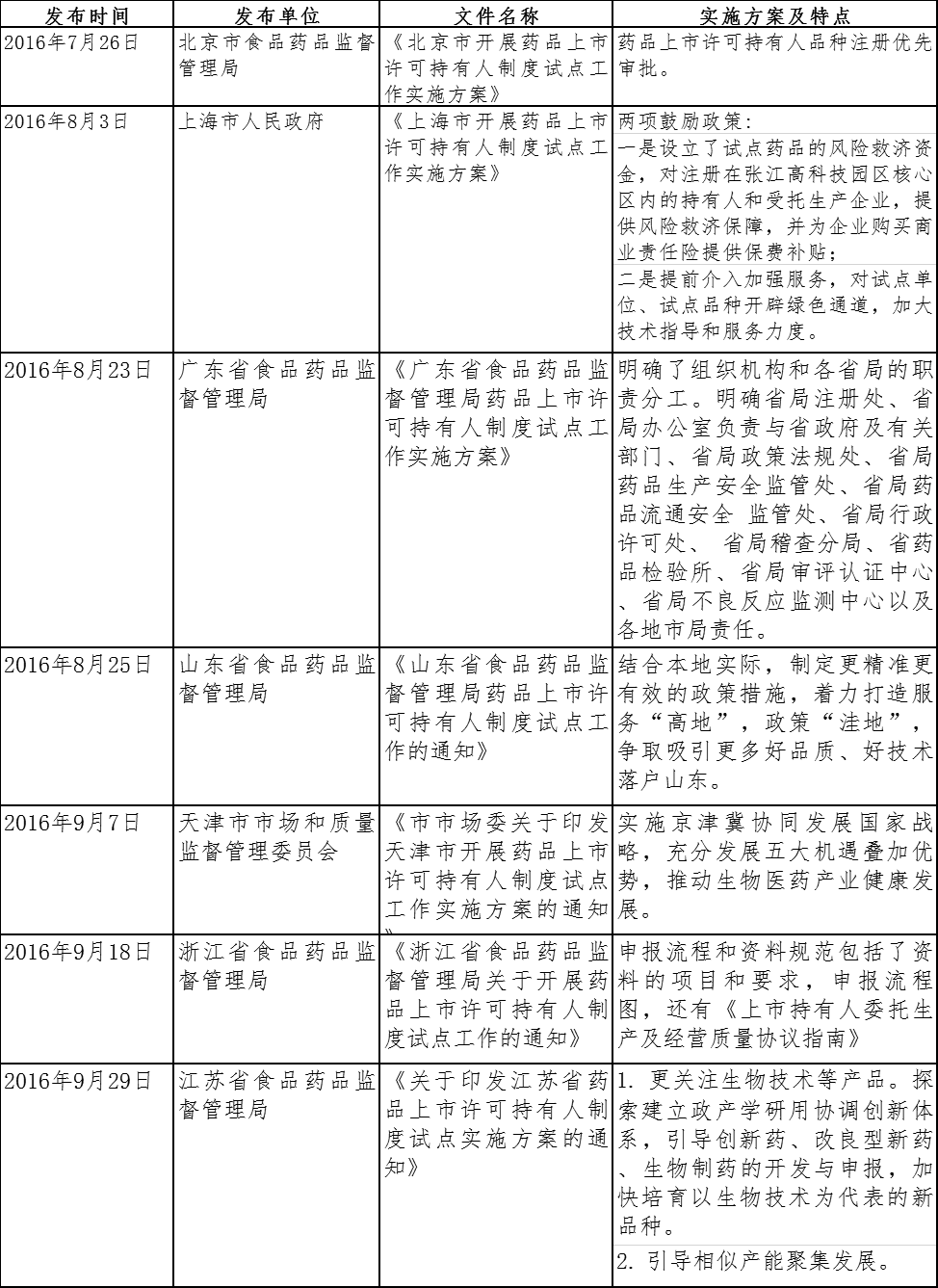
新《药品管理法》实施后,我国药品管理将由MAH试点地区与非试点地区的“双轨”并行制,逐步过渡到MAH制度的“单轨”监管制。在过渡期间,MAH制度中对MAH管理能力、责任承担能力有要求,对于无法承担MAH责任的企业,可以通过技术转让或是收购、兼并、重组的方式,优化资源配置,应对挑战。本文拟围绕新法下药品上市许可及技术权属转让的相关问题进行讨论。
新法下药品上市许可及技术权属转让的技术内容
项目标的、范围、形式和要求
受让方和转让方达成药品文号生产技术转让协议,标明合同标的,即转让方作为转让药品的药品上市许可持有者,在合同有效期内转让方将药品上市许可持有人转让给受让方,并协助与配合受让方完成相关的补充注册申请,包括药品上市许可转让和药品生产场地变更两项补充申请,直至受让方取得药品监督管理部门颁发的药品注册证书并成为该药品上市许可持有人,且该药品生产场地从转让方生产场地变更至受让方生产场地,受让方获得药品生产场地变更补充批件。
MAH可变更补充申请,根据《药品管理法》《药品注册管理办法》(以下简称《办法》)等法律法规相关条款,转让方依法成为合同项目的MAH后,按照《办法》第七十八条第三款“持有人转让药品上市许可”及后续相关补充申请细则要求,将合同项目的MAH转让给受让方,经国家药品监督管理部门批准后使受让方成为合同项目的MAH。
技术内容、范围、形式和要求
转让方应按照相应的药品注册管理办法要求和后续受让方持有该品种上市许可后经营的考虑,将合同项目上市许可相关的全部药品生产技术,包括但不限于药品处方、生产工艺、技术秘密、与该品种相关的专利、技术资料数据、客户资料、招投标情况等交付给受让方。转让方负责指导受让方技术人员在药材购置以及在受让方或受让方指定的GMP车间连续生产出数批符合商业批生产规模的合格样品。
项目保密范围和保密期限
转让双方直接或间接涉及本合同项目的人员,自合同生效之日起对合同涉及的所有技术资料,如生产工艺和工艺参数、质量研究资料(包括质量标准建立的过程)、原研对比研究、稳定性试验等,均应严格保密,任何一方不得以任何借口向另外一方之外的任何其他主体(包括法人、自然人)泄露或转让。依照法律规定向政府机关、法院提供材料,或者为履行本协议向相关职能人员提供材料,或者相关资料被第三方合法公开,构成保密限制的例外。保密期限由双方协商确定。
自合同生效之日起,转让方不得再与其他厂家合作合同项目,使用与合同相同产品和规格的技术秘密,如有此类事件发生,经确认为转让方泄露或转让的事实后,转让方应赔偿受让方相应的经济损失(包括但不限于直接投资损失、诉讼费、律师费、执行费等),并退还受让方已支付的技术转让费。
新法下药品上市许可及技术权属转让双方的权利和义务
受让方的权利与义务
受让方应按本合同的约定按时足额向转让方支付技术转让费,并在药品上市许可转让的具体条件、程序、范围等法规出台后尽快提供药品上市许可转让补充申请注册申报所需的技术交接资料明细清单,如有落项可以再次向转让方索取,转让方必须全力配合;同时应根据合同约定的时间负责组织对转让方提供的合同项目的全部技术资料的接收,提供样品生产和检验的场所及条件,并在转让方的技术指导下完成连续三批生产规模样品的生产、质量检验、稳定性考察;受让方负责在本方或本方指定场地连续三批生产规模样品生产的所有费用,同时在样品生产期间,负责转让方协助人员的住宿和餐饮费用;受让方成为合同项目药品上市许可持有人后,在转让方的协助下负责合同项目药品生产场地变更工作。
转让方的权利与义务
转让方保证本协议所约定的药品上市许可均系合法取得,且该等药品上市许可对应的药品品种均具备符合转让要求的技术条件、技术人员、生产设备和生产环境。同时应按照双方约定,在合同生效之日且受让方支付第一笔款项起1个月内完成约定部分技术资料的交接工作,并确保所提供的全部资料真实、有效、完整、可行。
转让方应协助受让方通过药品监督管理部门对合同项目的药品上市许可转让及药品生产场地变更的补充注册申请、审评和审批工作,负责配合受让方完成合同项目的注册补充申请,帮助受让方解决权属转移过程中出现的相关技术问题,直至受让方获得药品监督管理部门的药品注册证书并成为MAH。在协议期间,如转让方转让的药品文号需要进行药品再注册申请,由转让方负责本协议约定的药品文号的再注册申请工作及相关费用,且保证能够获得再注册批件。
在药品监督管理部门批准受让方成为合同项目药品上市许可持有人的补充申请后,在转让方GMP车间或受让方指定的GMP车间负责安排专业技术人员,负责指导受让方在GMP车间完成连续约定批数符合商业批生产规模的合格样品,且实际生产工艺与注册工艺相符。
转让方应当承诺并保证在合同项下转让的药品技术不存在所有权及知识产权争议或相关未决的诉讼,合同项下的合同项目的新药证书和药品上市许可为转让方合法持有;在合同经双方签字盖章后,转让方不得再以变卖、赠予、抵押、转移等任何方式处置本合同项下转让的药品技术;在合同项下的药品技术转让成功后,转让方承诺不再生产该药品。在MAH变更之前,转让方有权继续生产销售本合同约定的药品。转让方应承诺药品的实际生产工艺和注册工艺相符,如在生产规模的样品过程中发现不符,受让方有权终止合同,要求全额退还已经支付的全部转让款。如因受让方原因导致实际生产工艺和注册工艺不相符,由此产生的后果由受让方负责,转让方不负责。(邓勇 朱谢君 北京中医药大学法律系)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









