创新重点实验室建设 支撑医学影像设备的科学监管和高质量发展
- 2021-04-20 14:04
- 作者:李非 郭柏军 孙智勇
- 来源:中国食品药品网
医学影像是指为了医疗或医学研究,对人体或人体某部分,以非侵入方式取得内部组织影像的技术与处理过程。医学影像设备包括医用X射线设备、X射线计算机体层摄影设备(CT)、磁共振成像设备(MR)、核医学设备、超声成像设备等,集聚了制造业的前沿成果和先进技术,是国家从制造大国走向制造强国最有潜力的突破点之一。《中国制造2025》明确把高性能医疗器械作为十大重点发展领域之一,而影像设备在高性能医疗器械中排第一位。
此次新冠肺炎疫情,影像产业针对应急公共卫生事件提供了全面的解决方案,包括以方舱、车载和移动影像设备等为代表的空间创新,以负压、隔室操作、AI辅助控制等传染控制为代表的路径创新,以远程会诊和AI诊断为代表的决策支持创新等,体现了我国影像产业基本具备了高质量发展的形势。
2019年,由辽宁省医疗器械检验检测院申报的“医用数字成像设备重点实验室”获国家药监局批复成立,致力于医学影像设备技术标准等的科研攻关,对数字成像设备的监管提供强有力的技术支撑。本文简要分析了医学影像产业现状和产业发展瓶颈,介绍了医用数字成像设备重点实验室在支持医学影像设备科学监管方面采取的措施,为促进医学影像设备的科学监管和产业高质量发展提供参考。
市场占比大 技术瓶颈待突破
在全球医疗器械市场中,医学影像设备排名第三,占比12%;在中国,医学影像设备是医疗器械市场的最大组成部分,占比16%。图1表示全球及中国医疗器械行业市场规模和器械组成部分。
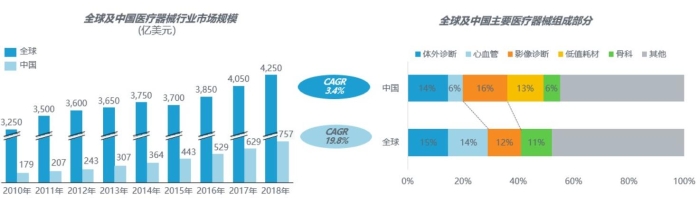
图1 全球及中国医疗器械行业市场规模和器械组成
医学影像产业链可细分为六个环节:分别为原料生产、零部件生产、核心组件制造、主机制造、系统集成和医院。原材料、零部件、电子元器件和机械加工业属于上游。核心组件和主机制造属于中游,核心组件包括:平板探测器、高压发生器、数据处理系统、超声探头等。医院属于下游。产业链如图2所示。
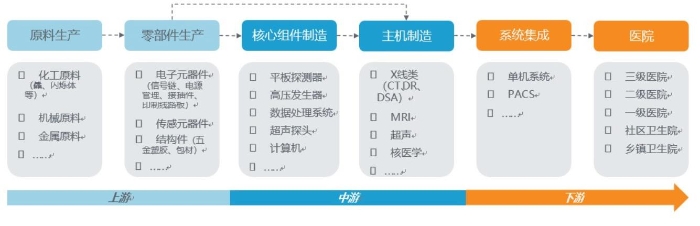
图2 医学影像产业链
医学影像设备整机是医学影像产业的主体,在X成像、核磁共振成像、超声成像、核医学影像、光成像及热成像六大类中,CT、MRI和超声为三大主要市场。
医学影像产业是中国医疗器械规模最大的细分市场,从产业链上看,越往上游国产化能力越弱。政策和需求不断推进中国医学影像市场发展,而国产医学影像设备技术成熟度主要分布于成长期,DR、超声、CT国产化程度较高,但大部分核心部件和高端设备主机制造仍依赖海外。
医学影像进出口价差较大,超声、DR、CT等存在国产替代、出口机会,目前国内影像设备出口金额最大的是超声、CT(DR暂未统计数据)。
X射线球管、高压发生器、平板探测器、数据采集系统是的DR核心组件,其中,中低端产品已实现国产、高端组件仍需进口。
CT球管、滑环、X线探测器和发生器、数据采集系统等CT技术核心组件壁垒较高,国产能力有待提高,CT的核心部件国产能力较弱,探测器、滑环、数据采集系统技术能力较弱。
超导磁体、射频发射器、射频线圈和放大器为MRI的核心部件,国内厂商自产能力与进口厂商差距较大。
国产高端超声探头已实现自产化,超声设备具备整体国产化基础。尽管目前国内高端探头(如彩超)仍然多数使用进口产品,但国内开立医疗、迈瑞医疗、祥生医疗均自主研发关键技术,超声设备主机和零部件的国产化正在推进。
PET设备的核心部件是探测器和数据处理系统,基本都来自进口。PET设备与CT设备类似,由机体、床、控制台、计算机几大部分组成,其中机体内核心部件是探测器,目前有部分国产,但高端设备均来自进口;另外,PET高度依赖计算机处理技术,对数据处理系统有较高要求,国产厂家有较大差距。
创新机制 服务全生命周期监管
医用数字成像设备重点实验室是医疗器械科学监管体系的重要支点,目标是全方位服务医用数字成像设备的“三全一新”,即全生命周期、全产业链、全检验资质和创新产品的技术支持,引领中国医用数字成像设备的未来。
第一,构建“检验、科研、标准”三位一体重点实验室工作模式。实验室构建了“检验、科研、标准”三位一体工作模式,结合监管和产业发展需要,实现科研推动标准、标准引领检测、检测反推科研的新机制。
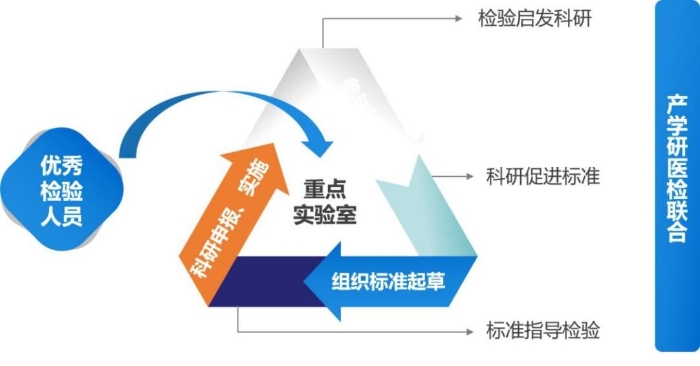
图3 重点实验室创新机制
通过组织协调生产企业、科研院所、临床机构、检测和监管机构互动与合作,促进“产学研医检”结合,构建质量评价标准体系。目前,重点实验室牵头或参与10项国家重点研发计划和省自然基金项目,涉及标准科研资金500万元以上。2020年成功申报《国产PET核心部件和产业化》《高热容量CT球管的研发和产业化》等国家重点研发计划数字诊疗重点研发专项2项,结题《磁共振设备性能评价》等国家重点研发计划数字诊疗重点研发专项2项。
第二,坚持问题导向,创新实验方法控制影像产品风险。重点实验室跟踪影像产品测试方法的发展方向,致力于用实验室方法控制影像产品风险。
制定市场准入标准,引导放射影像设备低剂量方向发展。针对中国放射检查频繁的国情,制定辐射安全类特殊要求。例如,通过标准制定,鼓励我国采用剂量利用效率更高的闪烁体探测器,使我国拍摄DR所用剂量降低了一半。儿童对于射线的敏感度很高,规定降低儿童辐射剂量所采取的措施,比如自动曝光控制,低剂量辐射协议,拆除滤线栅等,从而大大降低了对儿童的辐射伤害。
创新影像设备图像质量的量化评价。针对数字医学成像设备非临床评价不充分的问题,创建实验室量化评价方法,以替代基于人体的临床试验,在统一参数的同时,大大方便和加快产品上市。例如,在国际上率先制定CT的图像性能量化评价标准,制定的高对比度分辨率评价统一了MTF测试的流程和工具,制定的LCD评价标准规范了采用基于模型观察器的客观对比评价。
牵头射线产品的监督抽验,评价产品上市后风险。针对产品上市后的质量问题,牵头进行国家药监局医疗器械监督抽验2个品种:乳腺X射线诊断设备和牙科X射线诊断设备,共完成15批产品抽检,其中1批次不合格,出具高质量的评价报告和风险提示函。
三方面发力 推动国产设备自主创新
全球疫情对产业发展、格局和未来产生了深远的影响,国产化医学影像设备在抗击疫情中发挥了巨大作用。笔者认为,作为国家药监局重点实验室应当从三个重点方向布局,支持国产医学影像设备产业的高质量发展:推进标准化工作改革支持影像产业创新、探索最小负担原则提高影像产品上市速度、加强检验检测能力建设提升医学影像产品质量可控性。
第一,推进标准化工作改革,支持影像产业创新。标准化改革涉及多个方面,可以从管理和技术两个维度提升支持影像产业创新的力度。
在管理方面,医疗器械标准管理战略需要实现的是双目标系统,即平衡保障医疗器械安全有效和促进医疗器械高质量发展。《系统论》中,双目标系统依赖双层结构的解决方案,对此,美国FDA采取平台战略形成二级结构,欧盟标准管理采取协调机制形成二级结构,建议研究制定中国特色的医疗器械标准管理的战略结构,即“平台+协调”的二元二级战略结构,对医疗器械标准扩展供给渠道,提高供给数量,加快制定速度,突破国际标准制定等,从而支持产业发展。
在技术方面,应聚焦并引领影像产业发展方向,包括:高端和新型数字化成像设备及功能的安全有效评价;新研究数字影像产品及核心部件的可靠性和可用性;医学影像设备人工智能相关的准确性和可靠性;研究影像远程诊断和操作的安全风险;新技术产品对人体生理效应的评价研究、大型医用成像设备的电磁兼容检测规范性研究。结合国家药监局医用数字成像设备重点实验室建设,围绕检测、科研、标准三位一体发展,与产学研医相结合,加强医疗器械标准的科研支撑能力,加强对基础通用、共性技术标准的研制,鼓励标准化科研人员与企业技术人员相互交流,提升医疗器械标准的科技含量,与医疗器械国际标准和其他先进标准同步发展。
第二,应用最小负担原则,提高影像产品上市速度。《全球科技通史》将人类社会的发展和科学的作用归结为能量和信息两个维度的进步。医疗器械注册审评审批是基于信息的科学,主要包括信息输入(注册申报资料)、信息处理(立卷审查、审评审批过程)和信息输出(审评结论、审评报告、注册许可)。
最小负担原则即“用最少量的必要信息,在适当的时间、以最有效的方式,恰当地解决相关监管问题或事项”。医疗器械注册审评审批致力于通过加快开发、评估、审查过程,帮助患者更及时地获得新的医疗器械并能够持续使用高质量、安全和有效的现有医疗器械,以符合其保护和促进公众健康的使命。通过减轻审评审批和行业负担,患者可以更早且持续获得有益的产品。最小负担原则适用于所有医疗器械及其全生命周期(含上市前和上市后),主要包括七条内容,分别是:
1.审评机构将要求提供必要的最少信息,以充分解决当前的审评问题;
2.企业在提交注册申报资料时,应保证审评机构负担最小;
3.采用最有效的方法解决问题,如充分的沟通交流,或者制定补正通知书的指导原则,提出补正通知书的要素“证据、差距、原因、期望”,清晰、简明地传达审评要求、期望、过程、政策和决定,以及这些背后的基本原理;
4.在合适的时机要求信息,如在合适和可行的情况下利用真实世界数据收集以减少对临床数据的要求;
5.与技术相适应并充分考虑特殊的产品创新周期、证据需求及患者需求;
6.在合理和可行的前提下利用和参考其他国家的数据和监管部门决策;
7.在实现国际医疗器械监管趋同和协调统一的工作中应用最小负担原则,如认可和使用国际和其它标准组织发布的标准。
应用最小负担原则有利于减轻审评负担,将有限的审评审批资源聚焦在高风险医疗器械产品,通过最有效的方式在最恰当的时机,利用最少量的必要信息进行有效监管,更好地促进最新的高质量、安全、有效和经济的医疗器械产品快速应用到临床,及进入市场来满足患者需求。
第三,加强检验检测能力,提升医学影像产品的质量可控性。高端医学影像设备雄踞制造业技术链和价值链的顶端,其最本质的特征是高质量,包括高性能、高稳定性和高可靠性。中国医学影像设备制造要实现突破,首先要解决制造质量问题,其关键是能否建立起坚实的技术基础支撑能力,而核心关键是能否首先建立起精密测量能力和全面检测能力。
我国需要加速实施“检测三能力”建设,即补齐精密检测能力,追平超精密检测能力,突破和掌握基于“完整精度”的检测能力。在这个意义上,制造与检测两种能力无法分家,必须实现制造检测一体化。只有构建起系统的精密检测能力,中国医学影像设备才能顺利从中低端向中高端迈进。
(作者单位:辽宁省医疗器械检验检测院)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:何璇)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有











