上海有机所揭示α-syn家族性遗传突变导致帕金森病的机理
- 2021-05-13 14:16
- 作者:
- 来源:中国科学院官网
5月11日,中国科学院上海有机化学研究所生物与化学交叉中心刘聪课题组与何凯雯课题组合作完成的研究成果Wild-type α-synuclein inherits the structure and exacerbated neuropathology of E46K mutant fibril strain by cross-seeding,在线发表在PNAS上。研究发现,α-突触核蛋白(α-synuclein, α-syn)的家族性突变E46K诱导其形成具有比野生型(wild-type,WT)纤维更强病理毒性的病理性纤维,导致小鼠出现早发性运动缺陷。E46K纤维可通过交叉接种(cross-seeding)的方式,诱导WT α-syn形成类似E46K的纤维结构(hWTcs纤维),且hWTcs纤维可诱发小鼠表现出类似E46K纤维的病理特征和早发运动障碍。该研究为理解α-syn纤维形成的选择性以及家族性帕金森病(familial Parkinson’s disease,fPD)的致病机理提供了新视角。
研究中,科研人员通过脑立体定位注射α-syn病理性纤维构建出PD小鼠模型,发现E46K纤维能够引发小鼠早发性运动缺陷,且在小鼠脑内引发内源α-syn形成大量病理性聚集体。相比于WT α-syn纤维,E46K纤维诱导内源性α-syn产生更多尺寸更小的聚集体且多分布于神经突而非胞体,该聚集体传播到相连脑区如黑质也更高效,显示出更强的流动性和细胞间传播的能力。研究显示,在体外用E46K纤维作为种子能够有效地诱导WT α-syn形成类似于E46K纤维结构的纤维(图1),且同样能在体内引起类似E46K纤维的病理变化。
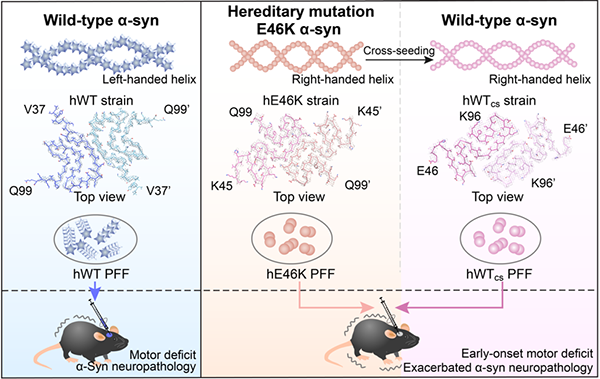
研究进一步从注射E46K纤维的PD小鼠脑内提取出内源诱导产生的α-syn纤维聚集体,并进行体外扩增。研究运用原子力显微镜表征发现E46K诱导小鼠内源WT α-syn产生的纤维拷贝了E46K纤维的结构特点。以上体内外实验结果均表明,E46K纤维能够通过cross-seeding作用把其病理构象传递给WT α-syn,从而共同作用引起早发性PD。由于目前发现的包括E46K在内的大部分α-syn的家族性突变均是杂合突变,故在病人体内WT与突变型α-syn蛋白共同存在。该研究有助于全面理解fPD致病机理(图2)。
上海有机所研究员刘聪和何凯雯为论文的共同通讯作者,博士研究生龙厚芳和郑玮彤为论文的共同第一作者。研究工作得到国家重点研发计划、国家自然科学基金委员会和上海市科学技术委员会等的资助。北京大学冷冻电镜平台对该工作提供了设施支持。
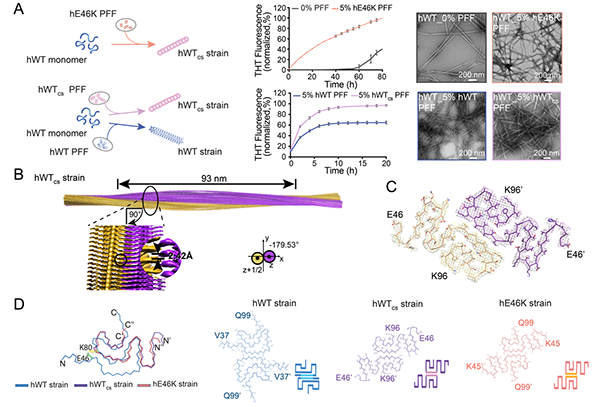
图1.E46K纤维体外交叉接种WT α-syn蛋白,形成与E46K纤维类似的结构
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐