中美欧注册对照谈|浅析新法规下我国药品检查体系特点
- 2021-05-18 10:05
- 作者:陈莉莉 周芳 徐娜
- 来源:中国食品药品网
新修订《药品管理法》和《疫苗管理法》(以下简称“两法”)为药品监督检查提出了新的要求,奠定了检查体系的基石。本文通过中国、美国和欧盟药品检查体系对比,详细解析新法规体系下我国药品检查的新变化。
我国药品检查体系基本建立
两法强化了药品研制阶段的管理和上市后监管,将保护和促进公众健康作为药品监管的立法宗旨,明确要建立职业化、专业化的检查员队伍。特别强调国家对疫苗实行最严格的监管,要求省级监管部门定期选派检查员入驻疫苗企业,检查员负责监督检查疫苗企业GMP执行情况。
新修订《药品注册管理办法》和《药品生产监督管理办法》(以下简称“两办法”)的出台,进一步推动中国建立国际先进的药品监管体系。根据两办法,“药品检查”是药品监管部门对药品生产、经营、使用环节的相关单位遵守相关法律法规规章、执行相关质量管理规范和药品标准等情况进行检查、调查、处置的行政行为。“药品注册核查”是指为核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等,对研制现场和生产现场开展的核查活动,以及必要时对药品注册申请所涉及的原料药、辅料及直接接触药品的包装材料和容器生产企业、供应商或者其他受托机构开展的延伸检查活动。
在两法和两办法框架下,国家药监局药品审评中心于2020年4月30日就《药品注册核查检验启动原则和程序管理规定(试行)》(征求意见稿)公开征求意见,通过建立基于风险评估机制的工作模式,针对不同药品注册申请按照不同比例启动注册现场核查,提高注册核查的针对性,提升核查资源的利用率。国家药监局药品审核查验中心于2020年5月22日就《药品注册核查实施原则和程序管理规定(试行)》(征求意见稿)》《药品注册核查要点与判定原则(征求意见稿)》公开征求意见,对药理毒理学研究、生物等效性试验和药物I、II、III期临床试验、药学研制和生产现场的核查要点和判定原则进行了详细阐述,旨在为药品注册核查提供统一、透明的工作程序和判定标准。国家药监局于2020年6月30日就《药品检查管理规定(征求意见稿)》公开征求意见,准备对检查工作具体实施要求、跨区域检查协调等做出明确规定,以确保药品监管工作能够尽快适应新形式,顺利开展,保障药品安全。中国食品药品检定研究院于2020年7月1日发布了《药品注册检验工作程序和技术要求规范(试行)》。至此,我国现阶段药品注册核查和注册检验的工作启动、实施和判定原则相对明确。
我国从法规层面建立了两法、两办法和相关管理规定三级体系,为现阶段药品检查体系的建立提供了法规依据。
中国、美国和欧盟药品检查体系对比分析
美国和欧盟药品检查相关的监管法律体系较为完备,涵盖了从药品研发到生产等全生命周期管理。美国以“垂直”的组织管理方式统一药品检查;欧盟则是按照集中和分权的方式协调各成员国对药品检查的监管思路。近年来,随着全球检查标准的统一,中国借鉴了美国和欧盟在药品检查法规、理念上的一些做法,强化基于风险管理的药品全生命周期监管理念的检查体系化建设,相继出台了多个细化的法规文件,为国内企业“出海”提供了强有力的制度支持。
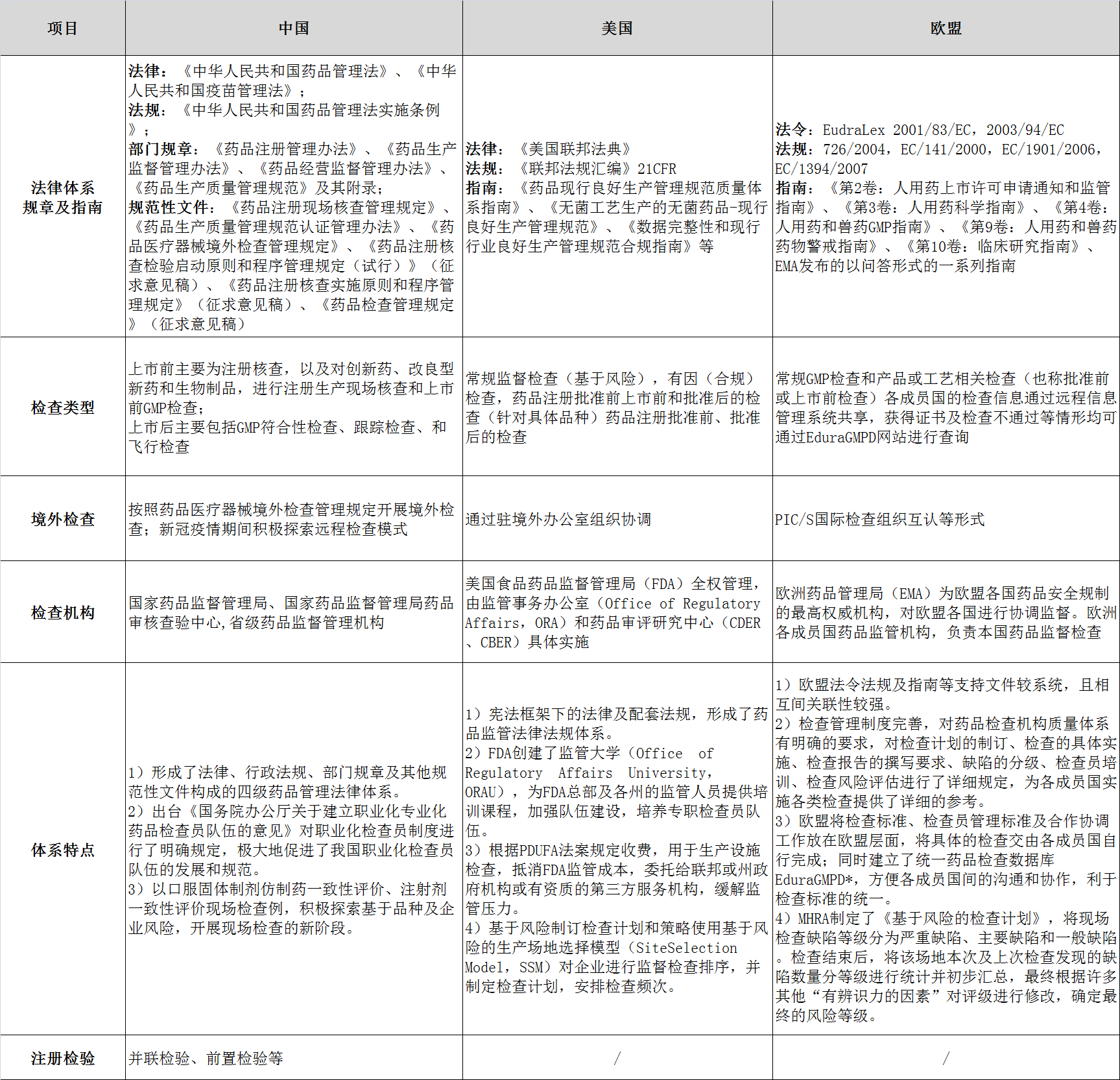
中国、美国和欧盟药品检查体系对比
中国和美国药品注册检查流程对比
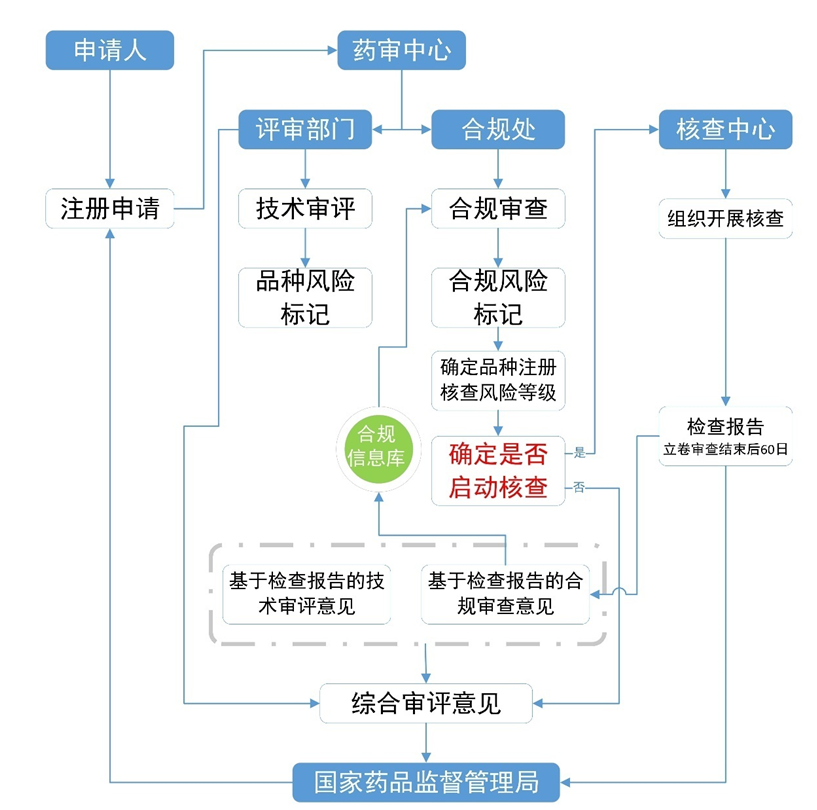
中国注册检查流程示意图
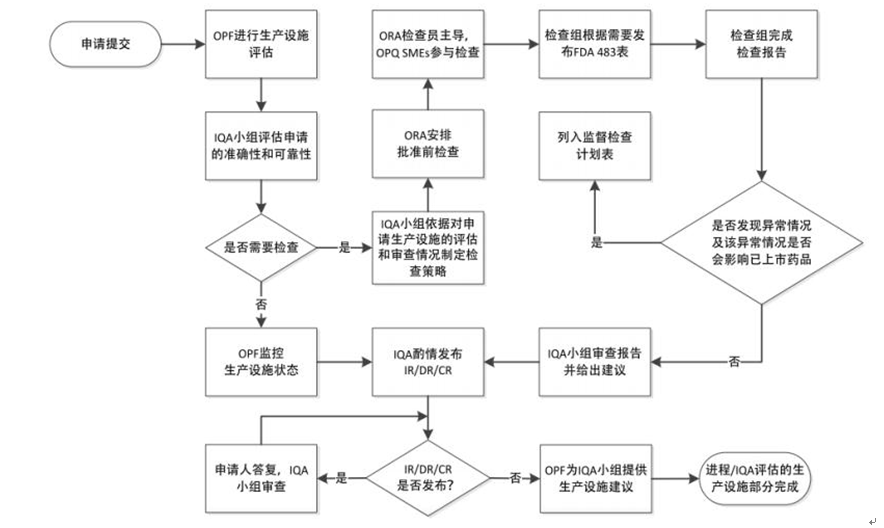
美国批准前生产设施检查流程示意图
分析和小结
通过对比美国和欧盟现有的药品检查体系和监管法规指南框架,笔者认为,美国ORAU检查员培训机构、欧盟检查数据库EduraGMPD统一的检查标准等都值得我国药品监管系统学习和借鉴。随着两法两办法的落地,我国药品监管机构持续完善药品检查技术支持性文件和指南,各省级监管机构也持续加强检查机构的质量体系建设,优化了检查资源配置。
2020年7月1日后,药品检查被赋予了新的内涵。在药品注册阶段,依据产品创新程度和风险特点,实行基于风险的审评、核查和检验模式,明确必须进行注册现场核查的情形,允许同步进行药品注册现场核查和上市前GMP检查,提高审评审批工作效率,体现了全面贯彻“放管服”改革要求。同时,全面加强监督检查,按照属地监管原则,对原辅包等供应商、生产企业开展日常监督检查,必要时开展延伸检查。2020年,在新冠肺炎疫情期间,由国家药监局核查中心与省级监管部门开展药品注册联合核查,截至2020年12月底,累计启动1112个品种的药品注册核查任务。核查中心在北京首次开展进口药品远程非现场检查试点工作,为疫情防控特殊时期进口药品的监管提供了专业技术支持。这些探索性工作的开展都取得了阶段性成果。
近年来,中国、美国和欧盟与世界卫生组织(WHO)、国际药品认证合作组织(PIC/S)等多个国际组织在药品检查领域开展了各种形式的交流与合作。2021年3月15日,PIC/S在2021年度工作计划中,将“完成与中国NMPA的加入谈判”列为优先事项,这将推动中国参加、共享并开展跨区域的联合检查,更好地协调国际检查资源,加强本国药品监管。中国作为医药大国,众多优秀本土企业逐步迈入国际化道路。与此同时,药品检查体系建设和企业迎接检查方面的能力亟待提高。目前,国内药品研发、制造企业迫切需要药品监管机构制订与国际通行法规接轨的法规、指南,加强国内、国际沟通协作,减少国际检查资源浪费,持续推进与欧美统一的检查标准和检查结果的国际互认。(翰森药业生物药注册副总监 陈莉莉,DIA中国法规事务社区核心成员、和铂医药注册事务总监 周芳,DIA中国法规事务社区核心成员、思路迪医药注册总监 徐娜)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐